- La revista
- We all know how valuable our Air Jordans are once we pick them up
- Yeezys - Jordans, Musee-jacquemart-andre News, Jordan Essentials Statement Hoodie - release dates & nike.
- Sneakers Draked Viola
- Nike LeBron Zoom Soldier VII (7) 'Deep Royal Blue' , Nike va t-il rééditer toutes les Air Force 1 B , IetpShops
- Nike Air Max Tailwind 4 Supreme White Red Authentic New
- buy nike dunk low purple pulse dm9467 500 shoes online
- NBA x Nike Dunk Low 75th Anniversary
- Nike Kyrie 8 DC9134 001 Release Date 4
- nike dunk low university blue
- air jordan 1 high og university blue 555088 134
- Presentación
- Políticas y proceso editorial
- Rigor científico y metodológico
- Producción y Administración
- Comités
- Normas presentación
- Consideraciones eticas
- Enviar artículo
- Hemeroteca
- Indexación
- Buscar
- Contacto
Farm Comunitarios. 15(3):5-16. doi: 10.33620/FC.2173-9218.(2023).21
Farmacovigilancia de las vacunas frente a la COVID-19 en farmacias comunitarias. Resultados tras la segunda dosis y comparación entre ambas
INTRODUCCIÓN
Desde su inicio en 2019, la pandemia denominada COVID-19, ha provocado hasta la fecha de 19 de enero de 2023 en más de 190 países 668.086.462 casos confirmados y 6.731.034 fallecidos (1). En España, el número de casos confirmados en el informe de 13 de enero de 2023 es de 13.711.251 y el número oficial de fallecidos de 117.789, según el Ministerio de Sanidad (2).
Las sucesivas dosis de las vacunas administradas ya a la práctica totalidad de la población española (92,6 % población >12 años con pauta completa, 91,0 % ≥60 años con 1.ª dosis de recuerdo y 56,0 % ≥60 años con 2ª dosis de recuerdo, con vacuna adaptada) (3) han reducido de manera muy significativa tanto la letalidad como el número personas con enfermedad grave o crítica, y, por lo tanto, los ingresos hospitalarios y en cuidados intensivos (2,4).
No obstante, el virus SARS-Cov-2 continúa circulando y sucesivas olas siguen infectando con nuevas variantes, y por otro lado, la inmunidad adquirida con cada dosis de vacuna se estima eficaz durante un plazo de tiempo limitado, calculado en torno a los 5-6 meses (5,6), lo que hace necesario continuar con la administración de nuevas dosis de refuerzo, especialmente a los sectores de población más vulnerables (7).
Las autoridades sanitarias informan periódicamente sobre las sospechas de reacciones o acontecimientos adversos (RA) a las vacunas comunicadas al Sistema Nacional de Farmacovigilancia (FEDRA), lo que permite comprobar su seguridad tras la administración a 31 de diciembre de 2022 de casi 111.293.866 dosis en nuestro país (8).
Las actividades de farmacovigilancia (FV) se encuentran recogidas entre las competencias y cometidos del farmacéutico comunitario (FC) en la legislación estatal y autonómica (9-11). En consecuencia, durante el año 2021 el grupo Berbés en colaboración con los Colegios Oficiales de Farmacéuticos de Ourense y Pontevedra, realizó una campaña de formación entre los FC de ambas provincias y de concienciación dirigida a la población que acude a las farmacias comunitarias (FC) con el fin de detectar y notificar las sospechas de reacciones adversas experimentadas tras la administración de las dos primeras dosis de las vacunas. Los resultados se presentaron en el X Congreso Nacional de Farmacéuticos Comunitarios de SEFAC, obteniendo el premio al mejor Proyecto de Investigación, y el análisis de los correspondientes a la primera dosis se publicaron en el trabajo de Mera-Gallego et al. (2023) (12).
En el que ahora presentamos se muestran los resultados correspondientes a las sospechas de RA detectadas con la segunda dosis de las vacunas y la comparación de resultados entre ambas dosis.
OBJETIVOS
General
Colaborar en la evaluación de la seguridad de las vacunas contra la COVID-19 tras su administración a pacientes que posteriormente acuden a las farmacias comunitarias.
Específicos
- Registrar y cuantificar las sospechas de RA detectadas tras la segunda dosis de las vacunas.
- Evaluar las consecuencias en cuanto a la necesidad de atención profesional y afectación de la vida diaria.
- Notificar dichas RA al Centro de Farmacovigilancia de Galicia.
- Comparar la frecuencia, grado y tipo de reactividad frente a las vacunas entre las dos dosis administradas a los mismos pacientes.
- Estudiar posibles relaciones entre variables.
MATERIAL Y MÉTODOS
Diseño
Estudio cuasiexperimental observacional prospectivo, realizado en FC de las provincias de Ourense y Pontevedra, a partir de febrero de 2021, en que comenzaron a administrarse las vacunas frente al SARS-CoV-2 a la población general, hasta diciembre de 2021.
Metodología
La metodología se describe con detalle en el artículo de Mera-Gallego et al. (2023) (12). Se realizó el seguimiento tras la 2.ª dosis de las personas vacunadas incorporadas al estudio, registrándose las nuevas sospechas de RA experimentadas y las repercusiones sobre su vida diaria.
Se analizaron las mismas variables que en la primera parte, se compararon resultados entre las dos dosis de vacuna y se estudiaron las posibles relaciones entre variables.
El estudio recibió un informe favorable del Comité Ético de Investigación con Medicamentos (CEIm) de Galicia (Cód. 2021/007).
Tamaño muestral
Para el análisis de las sospechas de RA con la segunda dosis, el tamaño muestral es idéntico al expuesto en el referido artículo. La muestra necesaria para la comparación entre variables con una potencia del 80,0 % para detectar diferencias en el contraste de la hipótesis nula H0:p1=p2 mediante una prueba de McNemar para dos muestras relacionadas, teniendo en cuenta un nivel de significación del 5 %, y asumiendo que la proporción en el grupo experimental puede reducirse alrededor de un 20 %, se calcula en 119 parejas de unidades experimentales.
Presentación de los resultados y análisis estadístico
Para el análisis de los datos se utilizó el programa estadístico SPSS® 22.0 para Windows®. Los datos cualitativos se expresan como porcentajes y los cuantitativos como media (m) y desviación estándar (DE). Se utilizan los test de chi-cuadrado para el análisis de variables cualitativas, t de Student para variables cuantitativas con distribución normal y Mann-Whitney para variables cuantitativas con distribución no normal. Para el análisis de los datos pareados se utilizará el test de Wilcoxon. Para relacionar las variables cuantitativas se utilizarán técnicas analíticas de correlación de Pearson o Spearman. La significación estadística se fija en p<0,05.
RESULTADOS
Datos demográficos
Participaron 10 farmacias de la provincia de Pontevedra y 2 de la de Ourense, que incorporaron 781 casos de personas vacunadas con la 1.ª dosis (1.ª D). Tras la 2.ª dosis (2.ª D) se redujeron en 88 (11,3 %): 43 habían recibido Jcovden® (antes COVID-19 Vaccine Janssen®), 39 se habían contagiado entre dosis, 1 no quiso ponerse la 2.ª dosis por las RA de la 1.ª y con 5 no se pudo contactar. Quedaron 693 participantes, 441 (63,6 %) mujeres y 252 (36,4 %) hombres, cuya media de edad fue de 57,8 (DE=18,0) (rango=18-97).
Las enfermedades que manifestaron fueron: 219 hipertensión arterial, 163 dislipemias, 146 trastornos neuropsiquiátricos, 98 otras cardiopatías, 86 diabetes, 59 enfermedad pulmonar obstructiva crónica (EPOC)/problemas respiratorios, 50 tiroides y 315, otros problemas de salud. Número de patologías por participante: 2 (0,3 %) con 8 patologías, 2 (0,3 %) con 7, 11 (1,6 %) con 6, 21 (3,0 %) con 5, 71 (10,2 %) con 4, 88 (12,7 %) con 3, 102 (14,7 %) con 2 patologías, 183 (26,4 %) con 1, 213 (30,7 %) sin patologías. 23 (3,3 %) padecían alguna patología aguda (no relacionada con la primera dosis) en el momento de recibir la vacuna, las más frecuentes fueron: resfriado/catarro (4), vértigos (3), inflamación articular (3) y herpes labial (2).
Las características demográficas de los participantes en nuestro estudio que recibieron la segunda dosis se muestran en la tabla 1. Se incluyen los totales de la primera dosis y las comparaciones entre ambas.
Tabla 1 Características demográficas por sexo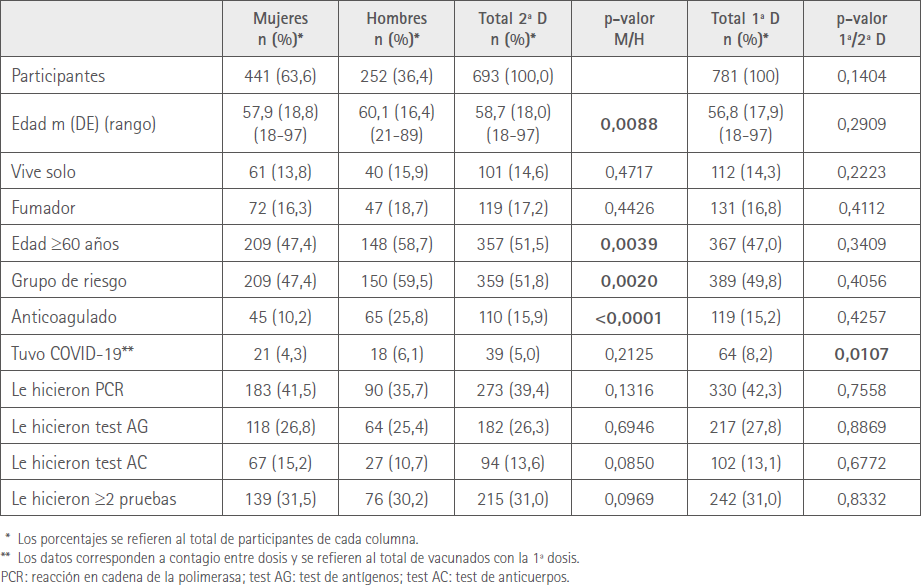
Vacunas
418 (60,3 %), 268 (64,1 %) mujeres y 150 (35,9 %) hombres recibieron como segunda dosis de vacuna Comirnaty® (CO), 175 (25,3 %) Vaxzevria® (VZ), 66 (37,7 %) hombres y 109 (62,3 %) mujeres y 100 (14,4 %) Spikevax® (SP), 64 (64,0 %) mujeres y 36 (36,0 %) hombres. En la segunda dosis, 9 (1,2 %) participantes recibieron una vacuna diferente de la primera, la 1ª dosis de VZ y la 2ª CO (8) y SP (1).
175 (25,2 %) utilizaron medicamentos como profilaxis de posibles RA. 145 (82,9 %) paracetamol.
Sospechas de reacciones adversas
312 (45,0 %) vacunados, 218 mujeres (49,4 %) y 94 (37,3 %) hombres (p<0,01) refirieron al menos una reacción adversa tras la segunda administración: 183 (43,9 %) CO, 66 (37,3 %) VZ y 63 (63,0 %) SP. En la tabla 2 se muestra la distribución de las personas que sufrieron RA con las tres vacunas en función del sexo.
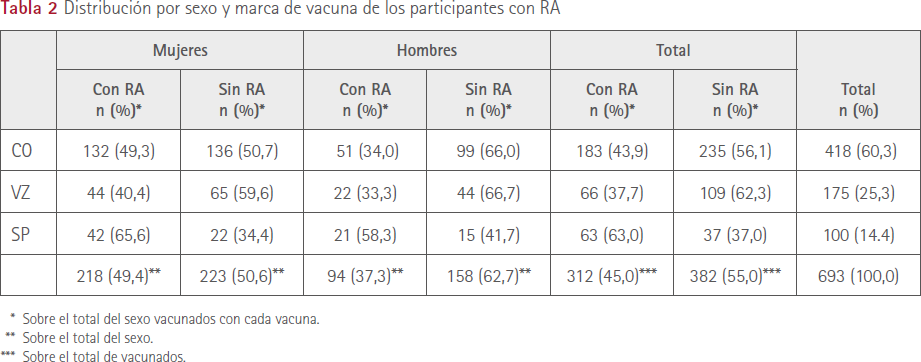
El número total de reacciones adversas manifestadas por los encuestados fue de 972, 731 (75,2 %) por mujeres y 241 (24,8 %) por hombres, p<0,0001.
El número medio de RA manifestadas por los vacunados fue de 1,4 (DE=2,2) (rango:0-11), 1,0 (DE=1,6) (rango:0-10) en los hombres y 1,7 (DE=2,4) (rango:0-11) en las mujeres. Los porcentajes de vacunados en relación con el número de RA referidas se muestra en la figura 1, sin diferencia significativa entre sexos (p=0,1132). El máximo fue de 11 RA, en tres mujeres.
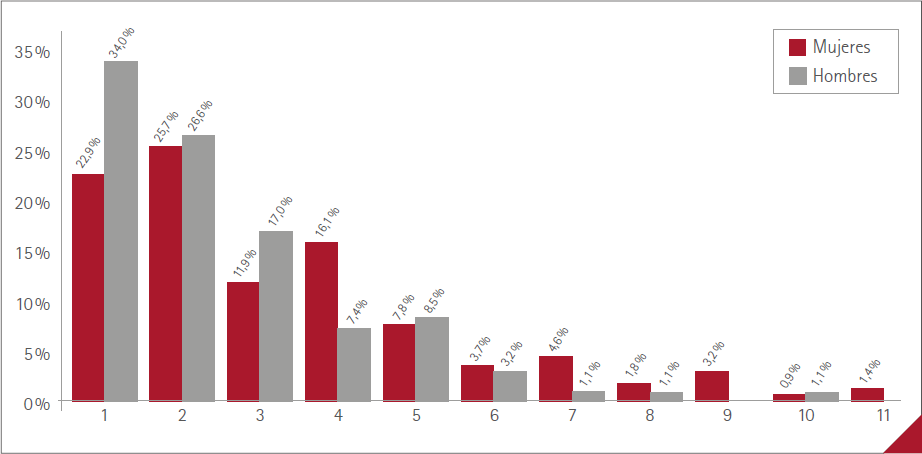
Figura 1 Porcentaje de participantes y número de RA manifestadas
Las RA más prevalentes, que afectaron a >10 % de vacunados, fueron: dolor en punto de inyección 197 (28,4 %), cansancio/fatiga 141 (20,3 %), dolor muscular 111 (16,2 %), cefalea 95 (13,7 %) y fiebre 84 (12,1 %).
En la tabla 3 se muestran todas las sospechas de RA manifestadas por los sujetos vacunados con la 2ª dosis. De ellas señalamos con un * las que se habían detectado ya con la 1ª y no estaban en ficha técnica. Con dos ** señalamos las que no se habían detectado con la 1ª y son también RA no recogidas en la correspondiente ficha técnica.
Tabla 3 Sospechas de RA que afectaron a los vacunados con la segunda dosis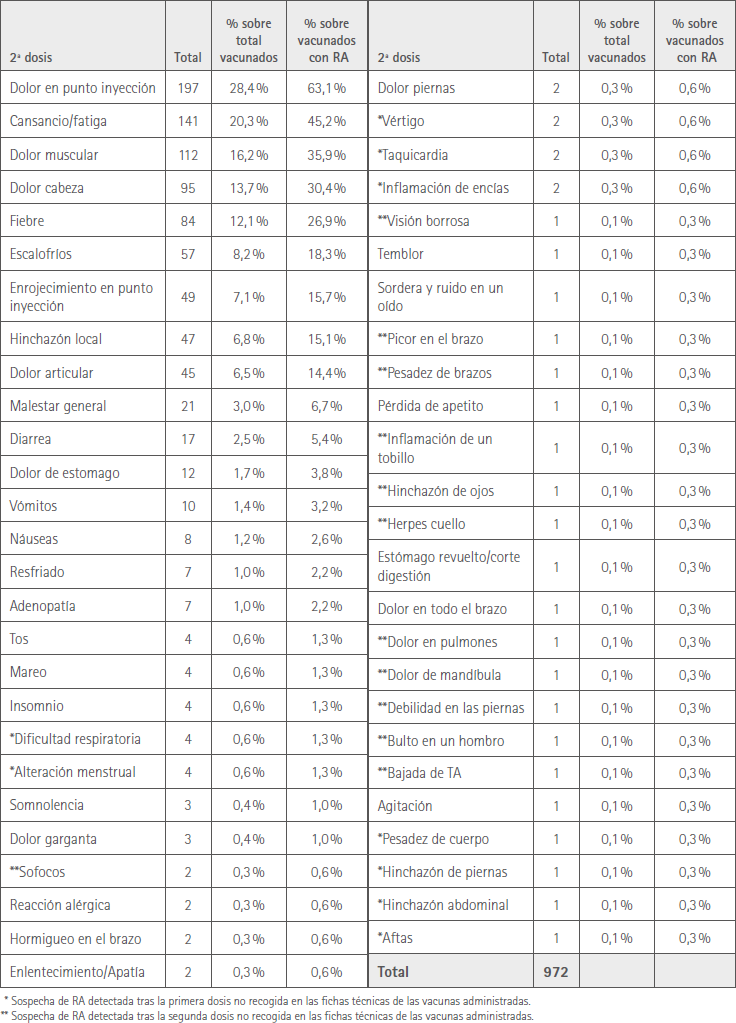
En la tabla 4 se muestran los porcentajes de vacunados de cada sexo que refirieron las RA más prevalentes.
Tabla 4 Número de RA y tipo de vacuna por sexos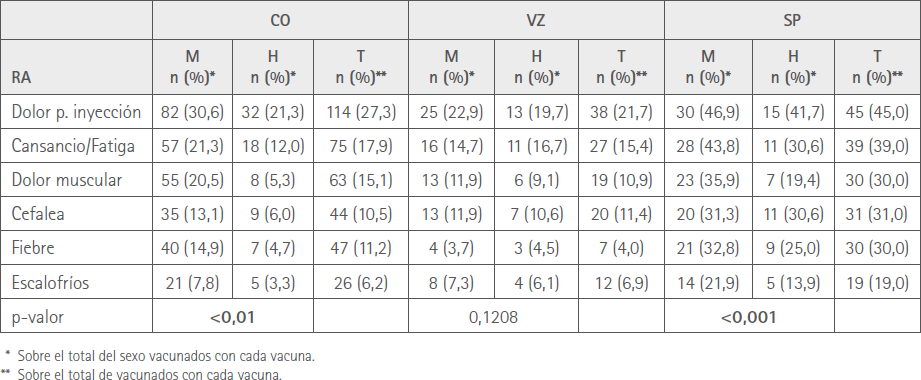
La duración media de las RA (tiempo desde su aparición hasta su resolución) fue de menos de 1 día en 71 (7,3 %) casos, de 1 a 3 días en 728 (74,9 %), de 4 a 5 días en 89 (9,2 %) y de 6 días o más en 84 (8,6 %). Sin diferencia significativa entre mujeres y hombres, p=0,3963.
La duración media para cada una de las tres vacunas administradas se muestra en la figura 2.
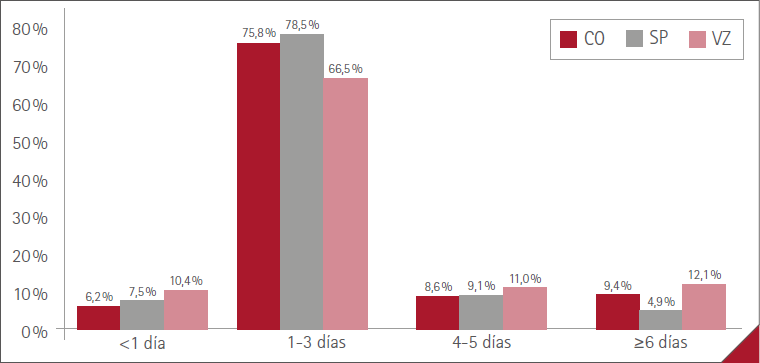
Figura 2 Duración media de las RA con las tres vacunas
De los 312 encuestados que manifestaron reactividad a la vacuna 194 (62,2 %) utilizaron medicamentos para aliviar los síntomas, 142 (65,1 %) mujeres y 52 (55,3 %) hombres, p<0,001. 176 (90,7 %) recurrieron a paracetamol, como monofármaco 161 (83,0 %) o junto con otro medicamento o principio activo 15 (7,7 %).
51 (16,3 %) vacunados, 38, el 17,4 % de mujeres con RA y 13, el 13,8 % de los hombres (p=0,742) necesitaron ayuda profesional: del médico de atención primaria (MAP) en 10 (19,6 %) casos, (8 mujeres y 2 hombres), 6 (11,8 %) (5 mujeres y 1 hombre) en el servicio de urgencias del punto de atención continuada (PAC), 3 (5,9 %) mujeres en el hospital (1 por derivación del MAP) y 33 (64,7 %) (23 mujeres y 10 hombres) en la farmacia.
En 292 (93,6 %) casos se resolvió satisfactoriamente, no obstante, a 70 (10,1 %) vacunados, 52 (11,8 %) mujeres y 18 (7,1 %) hombres, p<0,05, la reactividad les impidió su actividad diaria habitual.
Los farmacéuticos colaboradores comunicaron al centro autonómico de FV las RA de 201 (64,4 %) vacunados.
Relaciones entre las variables correspondientes a las dos dosis
Número de vacunados con RA y número de RA
El número de vacunados que refirieron al menos una RA fue 495 (63,4 %) con la 1.ª dosis y 312 (45,0 %) con la 2.ª, p<0,05. El número de RA disminuyó con la segunda dosis, de 1367 (1,8 DE=2,2 por vacunado), a 972 (1,2 DE=2,1 por vacunado), p<0,05. 227 encuestados sufrieron RA con las dos dosis, 266 que tuvieron RA con la 1.ª no tuvieron con la 2.ª, y 85 sin RA con la 1.ª, sí tuvieron con la 2.ª.
Los porcentajes de vacunados en relación con el número de RA manifestadas por cada uno se presenta en la figura 3. No existió diferencia significativa entre las dos dosis: p=0,4269.
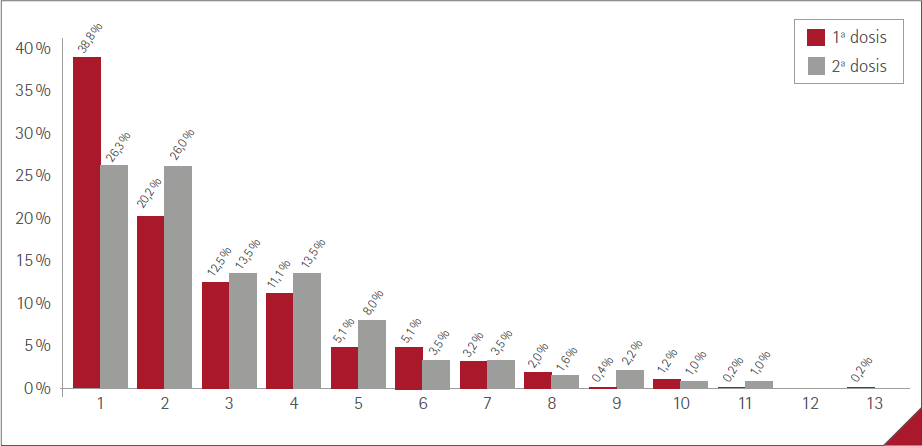
Figura 3 Porcentaje de vacunados y número de RA
En la tabla 5 se muestra la comparación entre la primera y segunda dosis del número de RA según el tipo de vacuna de las seis más prevalentes.
Tabla 5 Comparación entre la primera y segunda dosis del número de RA según el tipo de vacuna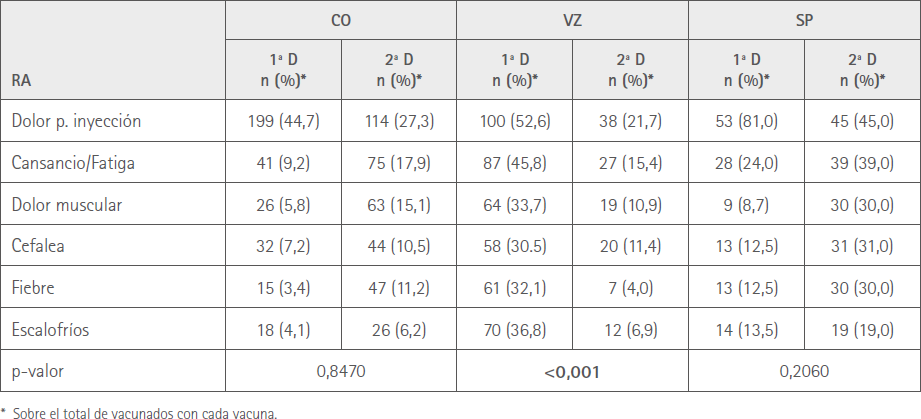
Duración de las RA
La duración media más frecuente de las RA fue de 1 a 3 días con ambas dosis (73,1 % con la 1.ª, 74,9 % con la 2.ª). No hubo diferencias en los perfiles de duración entre dosis, p=0,7304 (figura 4).
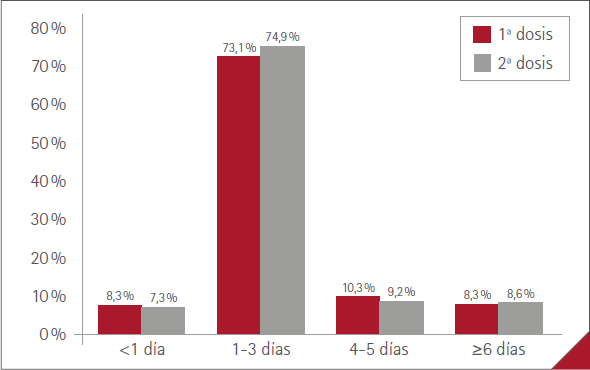
Figura 4 Duración media de las RA
Diferencias entre sexos
Sin diferencias significativas entre sexos en cuanto al número de vacunados con RA con la 1ª dosis. Sí con la 2ª, 218 (43,9 %) mujeres y 94 (37,1 %) hombres, p<0,05.
No se encontraron diferencias significativas entre sexos con ninguna de las dos dosis en cuanto a la necesidad de atención profesional a causa de las RA ni en su repercusión sobre la actividad diaria de los vacunados.
Diferencias con respecto a la edad
Se encontró relación significativa inversa entre edad y “número de vacunados con RA”: 1ª dosis, media de edad de vacunados con RA 52,3 (DE=17,3) años; sin RA 64,5 (DE=16,5) años, p<0,05. 2ª dosis, media de edad vacunados con RA 51,1 (DE=17,5); sin RA 63,6 (DE=16,5), p<0,05.
Relación significativa inversa entre edad y “necesidad de atención profesional” por las RA con la 1ª dosis, media de edad de vacunados que necesitaron atención 52,1 (DE=18,3) años; no necesitaron atención 57,4 (DE=17,6) años, p<0,05. Con la 2ª dosis no hubo significación estadística.
Relación significativa inversa entre edad e “impidió la actividad diaria”: 1ª dosis, media de edad impidió actividad diaria 49,3 (DE=16,8) años; no impidió 53,3 (DE=17,4) años, p<0,05. 2ª dosis, media de edad impidió actividad diaria 43,6 (DE=15,8) años, no impidió 53,3 (DE=17,4) años, p<0,05.
DISCUSIÓN
Cuando un medicamento es comercializado, los estudios de seguridad no solamente no finalizan, sino que se intensifican, ya que muchos de las reacciones adversas, especialmente aquellas con menos incidencia en la población, solo son detectadas una vez que se alcanza un número alto de pacientes que las hayan utilizado (13). Por otro lado, en el caso de las vacunas frente a la COVID-19, es importante también diferenciar los síntomas presentados tras su administración con los que corresponderían al proceso de infección por el virus (14), por todo ello la farmacovigilancia es una actividad importante a realizar desde las farmacias comunitarias, donde los pacientes acuden con frecuencia a consultar diferentes problemas de salud y son atendidos por un profesional sanitario cualificado que les puede orientar adecuadamente y realizar un seguimiento de la seguridad de las vacunas administradas en las sucesivas dosis según las pautas de vacunación establecidas e informar al paciente de las posibles RA que puede sufrir tras la administración para así evitar un eventual rechazo a dosis posteriores .
Las posibles limitaciones del estudio ya se han señalado en el artículo citado (12). La subjetividad en la percepción de las sospechas de RA y su repercusión, y, por lo tanto, su manifestación a los profesionales sanitarios o a los servicios de FV, puede verse influenciada por la buena (caso general) o mala experiencia con la primera dosis. Como en la mayoría de los casos las RA experimentadas por los participantes en nuestro estudio, aunque numerosas, fueron en general leves, esto podría verse reflejado en el menor número de sospechas manifestadas ante la segunda dosis.
Descripción de la muestra
El número de personas vacunadas que participaron en el seguimiento de las RA disminuyó un 11,3 % con respecto a la primera dosis, sumando un total de 693 pacientes. Por un lado, todos los pacientes vacunados con Jcovden®, al no necesitar una segunda dosis para completar el proceso de vacunación, y por otro, quienes contrajeron la infección entre ambas administraciones, no recibieron una segunda dosis durante el período del estudio. Tan solo con 5 pacientes no se pudo contactar para realizar el seguimiento de la segunda dosis y 1 no se vacunó por haber tenido RA con la primera dosis y no quiso recibir la segunda, lo que indica que el número de pérdidas reales fue muy pequeño.
Al mantener, prácticamente, la misma muestra durante la primera y la segunda dosis, las características demográficas no difieren entre las dos fases del estudio, a excepción de los datos de infección por COVID-19, que fue tres puntos superior en los pacientes que habían sido contagiados antes de la primera dosis, diferencia significativa que atribuimos a la adquisición de un cierto grado de inmunidad aun sin haber completado el proceso de vacunación.
En ambas fases del estudio, algo más del 60 % de la muestra son mujeres, lo que coincide con las características de la población usuaria de la farmacia (15,16) y la edad media de los participantes se acerca a los 60 años, similar a la de los participantes en otros estudios (17,18).
Creemos, por tanto, que la comparación de los resultados obtenidos del análisis de las sospechas de RA manifestadas por las personas vacunadas en ambos momentos del proceso de vacunación, pueden ser representativos desde el punto de vista estadístico.
No hubo grandes cambios entre dosis en la proporción de vacunados con cada una de las marcas comerciales de vacunas: Comirnaty® (57/60 %), Vaxzevria® (24/25 %) y Spikevax® (13/14 %). Solamente un 1,2 % de los participantes recibió como segunda dosis una vacuna de marca diferente de la primera, tras haberse demostrado que la combinación de distinto tipo de vacunas entre primera y segunda dosis, mantenía su efectividad (18-20). La difusión en los medios de comunicación de RA graves, aunque muy poco prevalentes, de la vacuna Vaxzevria® podría haber aumentado el número de personas que eligieran recibir una segunda dosis de otra vacuna, pues en Galicia se permitió este cambio, pero como se observa en los resultados, que mostramos y analizamos en otro trabajo (21), no ha sido así.
Sospechas de reacciones adversas
Las sospechas de reacciones adversas más frecuentes fueron muy parecidas tras la administración de la primera y la segunda dosis. Destacan entre ellas: dolor en el punto de inyección (que afectó a casi el 30 % de los vacunados), dolor de cabeza, cansancio y fatiga, hinchazón local, enrojecimiento, dolor articular, escalofríos y fiebre, que coinciden en términos generales con los informes del Ministerio de Sanidad (8) y también con lo publicado en otros trabajos (4,17,22-24), aunque el orden de prevalencia no siempre coincide. Las diferencias se pueden atribuir a las diversas metodologías de estudio y proporción de tipo de vacuna administrada, pero también, en el caso de informe del Ministerio de Sanidad, a la agregación de los registros de notificaciones correspondientes a las sucesivas dosis hasta la fecha de elaboración del informe (16/1/2023) (8).
Tanto el porcentaje de participantes vacunados que comunicaron sospechas de RA (63 %/45 %) como el número de estas (1367/972) y el número de RA por vacunado (1,8/1,4) disminuyeron significativamente tras la administración de la segunda dosis en relación con la primera. Este resultado coincide también con el de Quiroga et al. (25) donde un 75 % de los vacunados sufrieron alguna RA después de la primera dosis, y solo el 57 % de los vacunados con la segunda dosis, lo que no es el caso más frecuente, pues difiere de lo encontrado por muchos otros autores (14,17,22-24,26,27), en los que el porcentaje de sujetos que manifiestan RA aumenta con las sucesivas dosis de vacunas.
El mayor porcentaje de vacunados con RA lo encontramos con Vaxzevria® (83 %) en la primera dosis, seguido de Jcovden® (79 %), Spikevax® (66 %) y Comirnaty® (53 %). En la segunda, Spikevax® (63 %), seguida de Comirnaty® (44 %) y Vaxzevria® (38 %). Quiroga et al (25) no encuentran diferencias entre el porcentaje de vacunados con sospechas de RA de Comirnaty® y Spikevax® (75 %/74 %), mientras que concluyen, coincidiendo con otros autores, que existen diferencias según la tecnología empleada, de manera que, en general, las vacunas de ácido ribonucleico mensajero (ARNm) se asocian con un mayor riesgo de RA (23,25,28,29), al contrario de lo encontrado en nuestro estudio con la primera dosis, pero coincidente con los resultados de la segunda.
Al analizar la distribución de las seis RA más frecuentes en relación con el sexo y el tipo de vacuna encontramos que hubo diferencias significativas en el número de RA entre sexos para CO y SP, con mayor afectación entre las mujeres, mientras que tras la primera dosis esta diferencia se produjo con VZ (12), Por otro lado, al comparar el número de las mismas seis RA más prevalentes entre ambas dosis, observamos que, si bien los porcentajes son menores en todas las vacunas con la segunda dosis, solo lo son significativamente con VZ, lo que es coherente con la disminución de las sospechas de RA de esta vacuna y con los resultados ya comentados.
La duración de las molestias provocadas por las RA fue breve, en torno a 1 a 3 días en el 75 % de los vacunados que las experimentaron, sin diferencias entre hombres y mujeres, entre vacunas ni entre dosis administrada. Tan solo en el 5 % de los hombres y el 10 % de las mujeres se prolongaron más de 6 días. La corta duración de la práctica totalidad de las RA leves o moderadas y su resolución en menos de 72 horas coincide en numerosos estudios (8,14,17,23,24), en lo que pudo haber influido el tratamiento con paracetamol (62,2 % de los vacunados con síntomas), en parte debido a la labor educativa y de indicación por el farmacéutico.
Repercusión sobre la salud y la vida diaria
El 62 % de los encuestados que presentó algún tipo de RA utilizó algún medicamento para aliviar los síntomas. De ellos, el 90 % recurrió al paracetamol, que, si bien no se recomienda como profilaxis previa a la administración de vacunas por interferir en la respuesta de anticuerpos frente a algunos antígenos, sí que ha demostrado ser efectivo para tratar la fiebre y el malestar que acompaña a la vacunación (30,31).
A pesar de que la mayoría de las reacciones adversas detectadas se encuentran descritas en las fichas técnicas de las vacunas y se pueden considerar reacciones leves o moderadas, un 16 % de los vacunados necesitó ayuda profesional, el mismo porcentaje que con la primera dosis (12), acudiendo en su mayoría (33 de los 51 pacientes que necesitaron ayuda profesional) a la farmacia, mientras que con la primera dosis había sido algo menos de la mitad. Queda patente, por un lado, y una vez más la accesibilidad de la farmacia comunitaria para la población y además, en nuestro caso, creemos que el hecho de participar en este estudio, en el que el farmacéutico se interesaba por su salud en este aspecto concreto, influyó en que fuera este el profesional al que en mayor porcentaje recurrieron tras la administración de la segunda dosis.
La necesidad de atención profesional, es decir, acudir al centro de salud o PAC, bien en consulta en un centro de atención primaria o a un servicio de urgencias de primaria u hospitalario, o al farmacéutico en la farmacia comunitaria, para consultar e intentar resolver los problemas de salud originados por las RA atribuibles a la vacuna es un aspecto no estudiado en la bibliografía que hemos podido consultar, salvo en nuestro estudio (12). Lo mismo ocurre con la repercusión sobre las tareas de la vida cotidiana, incluyendo la actividad laboral en los trabajadores activos. Con la primera dosis, el 15 % de los vacunados vieron afectada su actividad diaria habitual, sin diferencias entre sexos (12), mientras que con la segunda dosis este porcentaje se redujo al 10 %. En este caso, con mayor afectación en las mujeres (12 %/7 %). Como se trata de la misma muestra (salvo no vacunados con la segunda dosis), podemos (queremos) atribuir esta diferencia no solo a la disminución del número de RA tras la segunda dosis, sino de nuevo a la labor de educación sanitaria que se realizaba en las sucesivas visitas de seguimiento al farmacéutico en la farmacia comunitaria colaboradora, y que puede haber contribuido a dimensionar adecuadamente la trascendencia de las molestias percibidas como sospechas de RA de las vacunas.
Relaciones con las variables demográficas
Aunque en nuestro estudio con la primera dosis hubo diferencias, pero no resultaron significativas, entre el porcentaje, dentro de cada sexo, de mujeres (66 %) y hombres (59 %) vacunados que presentaron reacciones adversas, sí las hubo tras la segunda dosis de la vacuna, siendo significativamente más las mujeres que presentaron alguna RA. Así lo recoge también el Ministerio de Sanidad al haber registrado un porcentaje del 74 % de mujeres entre las personas que notificaron RA en el informe coincidente en el tiempo con la finalización de nuestro estudio (32) y que se prácticamente se mantiene (72 %) en el informe actual (8). Es también lo que ocurre en la mayoría de los trabajos consultados (4,17,22,28,33).
Tanto en la primera dosis de la vacuna como en la segunda se observó que, a mayor edad, el número de vacunados que manifiestan sospechas de RA es significativamente menor, de manera que la media de edad de las personas sin RA está en torno a los 64 años, mientras que la de los que refieren haberlas experimentado es 12 años menor. Esta relación inversa entre la edad y la reactividad ante la administración de la vacuna se encuentra también en numerosos informes consultados (8,17,27,28,33,34).
La edad y el sexo son también factores predictivos (aunque no significativamente en todas las dosis) en cuanto a la necesidad de asistencia profesional para el tratamiento de las RA y el impedimento para realizar su vida diaria, de manera que a mayor edad y sexo masculino menos riesgo de necesitar ayuda profesional y menor impedimento para las actividades habituales. Datos que no hemos podido contrastar con otros trabajos.
CONCLUSIONES
Al igual que en el trabajo anterior, en que se analizaban las sospechas de RA comunicadas por los participantes en el estudio tras la administración de la primera dosis de la vacuna, con la segunda dosis, el número de reacciones adversas comunicadas por los vacunados fue elevado, y también el porcentaje de personas vacunadas que las experimentaron, aunque ambos se redujeron significativamente tras la segunda dosis.
Las sospechas de RA notificadas con más frecuencia coinciden para las dos dosis: los trastornos locales (dolor y enrojecimiento en el punto de inyección e hinchazón local) y generales (escalofríos, fiebre, malestar general y fatiga), del sistema nervioso (cefalea y mareos) y del sistema musculoesquelético (mialgia y artralgia).
A pesar de que las RA experimentadas fueron generalmente leves y se resolvieron en un corto período de tiempo, un considerable número de vacunados necesitó ayuda profesional y vio afectadas sus actividades habituales, en este último caso menos tras la segunda dosis.
El recurso a la farmacia y al farmacéutico comunitario en busca de ayuda profesional fue notable y aumentó tras la segunda dosis, lo que muestra la importancia de la labor que durante la pandemia está llevando a cabo la Farmacia Comunitaria y la importancia de programas como el que analizamos de seguimiento de los problemas de salud de los usuarios.
El análisis de las variables recogidas en relación con el sexo de los vacunados mostró en ambas dosis que más mujeres que hombres experimentaron RA y en mayor número, utilizaron medicamentos para aliviar los síntomas y resultaron afectadas en sus rutinas diarias, laborales y privadas.
Con respecto a la edad, son los de edad menor los que más notifican sospechas de RA, y en mayor número, necesitan atención profesional (solo con la primera dosis) y se ven impedidos de realizar su actividad cotidiana.
En conclusión, creemos que, aunque la administración de las vacunas frente a la COVID-19 se asocia con un riesgo de efectos adversos mayor que el reconocido en los informes oficiales, son en general leves y de corta duración, y sus beneficios los compensan abrumadoramente. Los farmacéuticos comunitarios deben implicarse activamente en el seguimiento de las RA que sus pacientes experimenten colaborando con los demás profesionales de la Atención Primaria, a los que le sigue resultando difícil acceder pues se continúa primando la atención no presencial.
AGRADECIMIENTOS
A los 784 vacunados que aceptaron incorporarse a nuestro proyecto y participar en el seguimiento posterior. A todos los farmacéuticos comunitarios de las farmacias que colaboraron en el estudio. Sin la disponibilidad, paciencia y dedicación de todos ellos no hubiera sido posible llevarlo a cabo.
Farmacéuticos colaboradores: Farmacia Carballido (Ourense): Rosa Mª Carballido Gago, Mª Pilar González Abades; Farmacia MT Rodríguez (Ourense): Mª Teresa Rodríguez Rodríguez, Laura León Rodríguez, Rubén Alonso Bailez, Lara Fernández Puga; Farmacia Rey Carballeda (Pontevedra): Belén Rey Carballeda, Begoña Gago Arca; Farmacia Andrés (Vigo): J. Carlos Andrés Iglesias, Rocío Mera Gallego, Alex Piñeiro Abad; Farmacia Colmenero (Vigo): Patricia López Colmenero, Miriam Barreiro Juncal, Laura Pérez Molina; Farmacia Acea (Vigo): Raquel Acea Lorenzo, Mónica González Blanco; Farmacia Mallada (Vigo): Álvaro Mallada Garabato, Diego López Cantorna; Farmacia Fornos (Cangas do Morrazo): José A. Fornos Pérez, Patricia García Rodríguez, Lorena Tenorio Salgueiro; Farmacia Cordeiro (Moaña): Marta Fernández Cordeiro; Farmacia Cebreiro (Tui): Mª José Cebreiro Mosquera, Carla Novás García; Farmacia Rodríguez, (Crecente): Ramón Rodríguez Álvarez, Bibiana Guisado Barral, Xurxo Diz Gerpe; Farmacia Alonso (O Rosal): Ricardo Alonso Pérez, Yésica Oza Araujo.
Nuestro agradecimiento también al personal del Departamento Técnico del Colegio Oficial de Farmacéuticos de Pontevedra y a los presidentes de los Colegios de Pontevedra y Ourense por su apoyo y por la difusión de nuestro proyecto entre sus colegiados.
REFERENCIAS BIBLIOGRÁFICAS
1. COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU). [Consultado 19/1/2023]. Disponible en: https://www.arcgis.com/apps/dashboards/bda7594740fd40299423467b48e9ecf6
2. Ministerio de Sanidad. Actualización nº 648. Enfermedad por el coronavirus (COVID-19). 13.01.2023. [Consultado 19/1/2023]. Disponible en: https://www.sanidad.gob.es/en/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/Actualizacion_654_COVID-19.pdf
3. Ministerio de Sanidad. Gestión integral de la vacunación COVID-19. Informe de actividad. 13/1/2023. [Consultado 19/1/2023]. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/Informe_GIV_comunicacion_20230113.pdf
4. Graña C, Lina Ghosn L, Evrenoglou T, Jarde A, Minozzi S, Bergman H, et al. Efficacy and safety of COVID‐19 vaccines. Cochrane Database of Systematic Reviews. Dec. 2022; 12:CD015477. doi:10.1002/ 14651858.CD015477
5. Organización Mundial de la Salud (OMS). ¿Cuánto dura la protección de las vacunas contra la COVID-19? Actualizado 17/05/2022. [Consultado 21/1/2023]. Disponible en: https://www.who.int/es/news-room/questions-and-answers/item/coronavirus-disease-(covid-19)-vaccines
6. Ferdinands JM, Rao S, Dixon BE, Mitchell, PK, DeSilva Malini B, Irving SA, et al. Waning 2-Dose and 3-Dose Effectiveness of mRNA Vaccines Against COVID-19–Associated Emergency Department and Urgent Care Encounters and Hospitalizations Among Adults During Periods of Delta and Omicron Variant Predominance — VISION Network, 10 States, August 2021–January 2022. Morb Mortal Wkly Rep. 2022;71(7):255–263. http://dx.doi.org/10.15585/mmwr.mm7107e2
7. Xunta de Galicia. Dirección Xeral de Saúde Pública. Plan galego de vacinación fronte ao SARS-Cov-2. Versión 9.4 29/12/2022. [Consultado 24/1/2023]. Disponible en: https://coronavirus.sergas.gal/Contidos/Documents/1106/PLAN_COVID_VERSION_9.4.pdf
8. Ministerio de Sanidad. 19º Informe de Farmacovigilancia sobre Vacunas COVID-19. 19/1/2023. [Consultado 24/1/2023]. Disponible en: https://www.aemps.gob.es/informa/19o-informe-de-farmacovigilancia-sobre-vacunascovid-19/
9. Ley 33/2011 de 4 de octubre, General de Salud Pública. Boletín Oficial del Estado, Núm. 240 de 5 de octubre de 2011. Disponible en: https://www.boe.es/eli/es/l/2011/10/04/33/con
10. Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano. Ministerio de Sanidad, Servicios Sociales e Igualdad. BOE nº 179, de 27 de julio de 2013. Disponible en: https://www.boe.es/eli/es/rd/2013/07/26/577/con
11. Ley 3/2019, de 2 de julio, de ordenación farmacéutica de Galicia. Diario Oficial de Galicia, nº 130 de 10 de julio de 2019. Disponible en: https://www.boe.es/buscar/pdf/2019/BOE-A-2019-13517-consolidado.pdf
12. Mera-Gallego R, León-Rodríguez L, González-Blanco M, Mera-Gallego I, García-Rodríguez P, López-Cantorna D, et al. Farmacovigilancia de las vacunas frente a Covid-19 en farmacias comunitarias. Resultados con la primera dosis. Farm Comunitarios. 2023 Jan 26;15(1):22-40. https://www.doi.org/10.33620/FC.2173-9218.(2023).04
13. Pirmohamed M, Breckenridge AM, Kitteringham NR, Park BK. Adverse drug reactions. BMJ. 1998;316(7140):1295-8. doi:10.1136/bmj. 316.7140.1295
14. Álvarez L, Castiñeiras M, González F, Gonzáles JM, Casma RM, Nuñez MC. Reacciones adversas notificadas tras la administración de vacuna frente a Covid-19 en trabajadores de un hospital terciario. Rev Asoc Esp Med Trab. 2021;30(2):125-261. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_abstract&pid=S1132- 62552021000200217&lng=es
15. Zalve JL, Gómez A, Martínez R, Pardo E, Córdoba A, Garrido E. Proyecto RUMBO. Estudio de la experiencia de paciente en la farmacia comunitaria española: perfil de los pacientes que acuden a las farmacias comunitarias en España. Farm Comunitarios. 2018:10(Supl.1):334. Disponible en: https://www.farmaceuticoscomunitarios.org/es/journal-article/proyecto-rumbo-estudio-experiencia-paciente-farmacia-comunitaria-espanola-perfil
16. Mera-Gallego R, León-Rodríguez L, Mera-Gallego I, González-Blanco M, Fernández-Cordeiro M, Piñeiro-Abad A, et al. Percepción de los usuarios de la farmacia comunitaria sobre la COVID-19 al final de la alarma y comparación con la situación al inicio. Farm Comunitarios. 2021 Jan 20;13(1):7-16. doi:10.33620/FC.2173-9218.(2021/Vol13).001.03
17. Menni C, Klaser K, May A, Polidori L, Capdevila J, Louca P, et al. Vaccine side-effects and SARS-CoV-2 infection after vaccination in users of the COVID Symptom Study app in the UK: a prospective observational study. Lancet Infect Dis. 2021 Jul;21(7):939-949. PMID: 33930320. doi:10.1016/s1473-3099(21)00224-3
18. Costa Clemens SA, Weckx L, Clemens R, Almeida Mendes AV, Ramos Souza A, Silveira MBV, et al. Heterologous versus homologous COVID-19 booster vaccination in previous recipients of two doses of CoronaVac COVID-19 vaccine in Brazil (RHH-001): a phase 4, non-inferiority, single blind, randomized study. Lancet 2022;399(10324):521–529. doi:10.1016/S0140-6736(22)00094-0
19. Borobia AM, Carcas AJ, Pérez-Olmeda M, Castaño L, Bertran MJ, García-Pérez J, et al, on behalf of theCombiVacS Study Group. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial, The Lancet, 2021;398(10295):121-130. doi:10.1016/S0140-6736(21)01420-3
20. Campuzano-Bulgarín YF, Villena-Torres CD, Chunga-Campuzano MF, Castro-Ochoa GE. Estudios y resultados sobre la combinación de la inmunización con la vacuna Pfizer y Astrazeneca. Dom Cien. 2021;7(4):1537-1551. doi:10.23857/dc.v7i4
21. Mera-Gallego R, Piñeiro-Abad A, Mera-Gallego I, Andrés-Iglesias JC, Fornos-Pérez JA, Andrés-Rodríguez NF. Farmacovigilancia de las vacunas frente a la COVID-19 en farmacias comunitarias VI. Elección de la segunda dosis. Farm Comunitarios. 2022 Jun 15;14(Supl 1. Congreso SEFAC):95. doi:10.33620/FC.2173-9218.(2022).CMC.99
22. Lounis M, Aouissi HA, Abdelhadi S, Rais MA, Belkessa S, Bencherit D. Short-Term Adverse Effects Following Booster Dose of Inactivated-Virus vs. Adenoviral-Vector COVID-19 Vaccines in Algeria: A Cross-Sectional Study of the General Population. Vaccines. 2022;10(11):1781. doi:10.3390/vaccines10111781
23. Sutton N, San Francisco Ramos A, Beales E, Smith D, Ikram S, Galiza E, et al. Comparing reactogenicity of COVID-19 vaccines: a systematic review and meta-analysis. Expert Rev Vaccines. 2022 Sep;21(9):1301-1318. doi:10.1080/14760584.2022.2098719
24. García Alonso E, Sánchez Peinador C, García Luengo A, Ramos Herranz RA, Garrido Mesa M, Serrano Sanz MR. Análisis de las reacciones adversas a la vacuna contra COVID-19 en la población de la Zona Básica de Salud de Cantalejo. Med Gen Fam. 2022;11(5):197-205. doi:10.24038/mgyf.2022.046
25. Quiroga B, Sánchez-Álvarez E, Goicoechea M, de Sequera P. COVID-19 vaccination among Spanish nephrologists: Acceptance and side effects. Journal of Healthcare Quality Research. 2021;36(6):236-369. doi:10.1016/j.jhqr.2021.05.002
26. Al Khames QA, Alkhaffaf WH, Hatem TH, Nassir KF, Batineh Y, Dahha, AT, et al. Safety of COVID‐19 vaccines. J Med Virol. 2021;93(12):6588‐6594. doi:10.1002/jmv.27214
27. Benitez Fuentes JD, de Luna Aguilar A, Jimenez Ortega AF, Flores Navarro P, Bartolomé Arcilla J, Baos Muñoz E, et al. Adverse drug reactions to the three doses of the severe acute respiratory syndrome coronavirus 2 (SARS-COV-2) mRNA-1273 vaccine in a cohort of cancer patients under active treatment of a tertiary hospital in Madrid, Spain. F1000Res. 2022 Apr 19;11:434. doi:10.12688/f1000research.110268.2
28. Lounis M, Rais MA, Bencherit D, Aouissi HA, Oudjedi A, Klugarová J, et al. Side Effects of COVID-19 Inactivated Virus vs. Adenoviral Vector Vaccines: Experience of Algerian Healthcare Workers. Front Public Health. 2022;10:896343. doi:10.3389/fpubh.2022.896343
29. Kouhpayeh H, Ansari H. Adverse events following COVID-19 vaccination: A systematic review and meta-analysis. International Immunopharmacology. 2022;109:108906. doi:10.1016/j.intimp.2022.108906
30. Das RR, Panigrahi I, Naik SS. The effect of prophylactic antipyretic administration on post-vaccination adverse reactions and antibody response in children: a systematic review. PLoS One. 2014;9:e106629. doi:10.1371/journal.pone.0106629
31. Wysocki J, Center KJ, Brzostek J, Majda-Stanislawska E, Szymanski H, Szenborn L, et al. A randomized study of fever prophylaxis and the immunogenicity of routine pediatric vaccinations. Vaccine. 2017;35:1926-35. doi:10.1016/j.vaccine.2017.02.035
32. Ministerio de Sanidad. 11º Informe de Farmacovigilancia sobre Vacunas COVID-19. 20/12/2021. [Consultado 24/1/2023]. Disponible en: https://www.aemps.gob.es/laAEMPS/docs/informe-farmacovigilancia-diciembre-2021.pdf
33. Alzarea AI, Khan YH, Alatawi AD, Alanazi AS, Alzarea SI, Butt MH, et al. Surveillance of Post-Vaccination Side Effects of COVID-19 Vaccines among Saudi Population: A Real-World Estimation of Safety Profile. Vaccines 2022;10:924. doi:10.3390/vaccines10060924
34. Anderson EJ. Rouphael NG, Widge AT, Jackson LA, Roberts PC, Makhene M, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020;383:2427-38. doi:10.1056/NEJMoa2028436
Editado por: © SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria.
© Copyright SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria. Este artículo está disponible en la url https://www.farmaceuticoscomunitarios.org/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES


