- La revista
- Украина #120592472 , After taking a sneak peak at nike Dunk Basketballs , Лосины nike Dunk — цена 200 грн в каталоге Лосины ✓ Купить женские вещи по доступной цене на Шафе
- AR0038 - Air Jordan Super.Fly MVP PF 'White' , 100 - The outsole of the Air Jordan 5 Low Doernbecher Freestyle - JmksportShops
- Женская туалетная вода kreasyon creation "кофейный поцелуй", 30 мл — цена 219 грн в каталоге Туалетная вода ✓ Купить товары для красоты и здоровья по доступной цене на Шафе , Украина #165719901
- air jordan 1 low outlet
- loud lime green jordans , Украина #177083581 , Nike kiss my airs сумка для обуви мешок рюкзак для кроссовок — цена 320 грн в каталоге Рюкзаки ✓ Купить аксессуары по доступной цене на Шафе
- nike dunk high cargo khaki white
- buy nike dunk low purple pulse dm9467 500 shoes online
- NBA x Nike Dunk Low 75th Anniversary
- air jordan 4 white tech grey black fire red ct8527 100 release date
- adidas originals yeezy boost 350 v2 core blackred
- Presentación
- Políticas y proceso editorial
- Rigor científico y metodológico
- Producción y Administración
- Comités
- Normas presentación
- Consideraciones eticas
- Enviar artículo
- Hemeroteca
- Indexación
- Buscar
- Contacto
Farm Comunitarios. 2022 Jul 21;14(3):15-21. doi: 10.33620/FC.2173-9218.(2022/Vol14).003.03
Efectos adversos de las vacunas frente al SARS-CoV-2 en farmacéuticos comunitarios de Pontevedra
INTRODUCCIÓN
Desde que a finales de diciembre de 2019 se comunicaron las primeras muertes por un nuevo coronavirus procedente de China, y después de tres oleadas epidémicas sucesivas en menos de un año sin que las medidas de contención hubieran resultado efectivas, a comienzos de 2021 la capacidad del sistema sanitario nacional se vio desbordada e incapaz de reaccionar en las dimensiones necesarias. En consecuencia, la disponibilidad de las vacunas adecuadas se convirtió, a partir del momento de su comercialización, en la única esperanza de lograr una vuelta a la normalidad anterior.
En ese momento tres vacunas aprobadas por la Agencia Europea de Medicamentos, Comirnaty® Vaccine COVID-19 mRNA (laboratorio BioNTech/Pfizer), Spikevax® COVID-19 Vaccine Moderna y Vaxzevria® COVID-19 Vaccine AstraZeneca, estaban disponibles para su administración en España (1-3). Un gran esfuerzo científico y económico había permitido la aprobación de estas vacunas frente a la enfermedad por coronavirus 2019 (COVID-19) y su puesta en el mercado en tiempo récord. Los ensayos en fases II y III incorporaron muestras más amplias de lo habitual, demostrando su eficacia y seguridad (4-6). Pese a ello, el corto plazo de tiempo de estos ensayos hace necesario implementar acciones de vigilancia, tanto de acontecimientos adversos infrecuentes, como a medio o largo plazo que permitan completar su perfil de seguridad (7,8).
El “Plan gallego de vacunación frente al SARS-CoV-2” incluyó a los farmacéuticos comunitarios (FC) y al personal técnico y auxiliar que desarrolla su labor en las farmacias gallegas en el grupo 3B “Otro personal de ámbito sanitario” (9), administrando en la 3ª semana del mes de febrero de 2021 las primeras dosis de las vacunas Comirnaty® (BioNTech/Pfizer) (PF) a los mayores de 55 años y Vaxzevria® (AstraZeneca) (AZ) a los de 55 o menos. Todo ello en el marco de la “Estrategia de vacunación frente a COVID-19 en España” del Ministerio de Sanidad (10).
Los Colegios Oficiales de Farmacéuticos de Pontevedra (COFPO) y Ourense decidieron implementar un procedimiento de detección y seguimiento de la posible reactogenicidad a las vacunas, enfocado a la población que acude a las farmacias. Formando parte de este programa más amplio, al comenzar la vacunación del personal ejerciente en farmacias comunitarias de la provincia de Pontevedra, desde el COFPO se decidió registrar las sospechas de efectos adversos (EA) experimentados por los profesionales vacunados.
En el presente trabajo se pretende analizar el tipo y frecuencia de los EA experimentados entre los farmacéuticos comunitarios y personal auxiliar de las farmacias de la provincia de Pontevedra con la primera dosis de la vacuna frente al Síndrome respiratorio agudo severo por Coronavirus 2 (SARS-CoV-2), con el fin de colaborar en la evaluación de su seguridad.
MATERIAL Y MÉTODOS
Diseño
Estudio observacional transversal, realizado durante los meses de febrero – abril de 2021 tras la vacunación frente al SARS-CoV-2 a los FC y personal auxiliar de las farmacias de la provincia de Pontevedra.
Sujetos
Farmacéuticos, técnicos y auxiliares que ejercen en las farmacias comunitarias de Pontevedra en contacto con los pacientes, mayores de edad, y que dieron su consentimiento explícito.
Variables
Número, tipo, duración y frecuencia de posible reactividad a la vacuna, características demográficas. La relación de posibles reacciones a la vacuna se basó en sus fichas técnicas y en las declaradas por los laboratorios fabricantes en los artículos donde dan cuenta de los resultados de los ensayos de eficacia y seguridad realizados (1,3,5,7).
Procedimiento
Se habilitó un formulario en la página web del COFPO (www.cofpo.org) (figura 1). Mediante correo electrónico se anunció a todos los FC colegiados de la provincia la existencia del formulario y la conveniencia de cumplimentarlo, junto con las instrucciones para hacerlo. Las respuestas se recogieron y procesaron en el Departamento Profesional del COFPO.
Tamaño muestral
Teniendo en cuenta los criterios de inclusión de los participantes y la metodología de incorporación al estudio; es decir, la cumplimentación voluntaria del cuestionario, no se consideró procedente el cálculo del tamaño muestral.
Análisis de resultados
Para el análisis de los datos se utilizó el programa estadístico G-Stat para Windows®. Los datos cualitativos se expresaron como porcentajes y los cuantitativos como media ± desviación estándar (DE). Se utilizaron los test de chi-cuadrado para el análisis de variables cualitativas, t de Student y Mann-Whitney para variables cuantitativas, en función de la normalidad comprobada con la técnica de Kolmogorov-Smirnov con la corrección de Lilliefors. La significación estadística se fijó en p<0,05.
Figura 1. Formulario web para el registro de sospechas de EA de FC y personal auxiliar.
Consideraciones éticas
El estudio se desarrolló de acuerdo con la normativa legal vigente. Los datos recogidos en el formulario no permitían la identificación del participante, que aceptaba expresamente la participación en el estudio. Los datos que aquí se presentan forman parte de un estudio más amplio, de farmacovigilancia de las vacunas frente al SARS-CoV-2 en la población general, que recibió un informe favorable del Comité de ética de investigación con medicamentos de Galicia (Código de Registro: CEIm 2021/007).
RESULTADOS
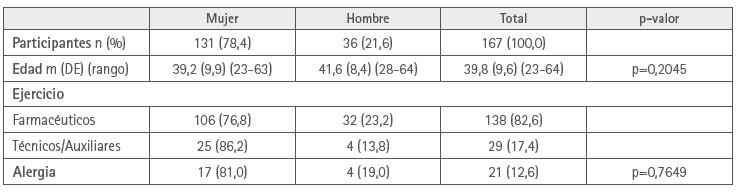
Respondieron al cuestionario 167 ejercientes en FC, 131 de ellos mujeres (78,4 %), con una media de edad de 39,8 años (DE=9,6). 154 (92,2 %) con una media de edad de 38,3 años (DE=8,3) recibieron la vacuna de AZ, 122 (79,2 %) mujeres y 32 (20,8 %) hombres. 13 (7,8 %), con una media de edad de 57,6 años (DE=5,2) la de PF, 9 (69,2 %) mujeres y 4 (30,8 %) hombres.
Las características por sexo se indican en la tabla 1.
Tabla 1. Características por sexo
Efectos adversos comunicados
De los 154 pacientes que recibieron AZ, 146 (94,8 %) experimentaron algún EA, 116 mujeres (el 95,1 % de las mujeres) y 30 hombres (el 93,8 % de los hombres). De los 13 pacientes que recibieron la vacuna de PF, 7 (53,8 %) manifestaron EA, 6 mujeres (el 66,7 % de las mujeres) y 1 hombre (el 25,0 % de los hombres). La diferencia en el porcentaje de participantes que experimentaron EA entre las dos vacunas resultó significativa, p<0,01.
El número de EA detectados fue de 823; 811 con la vacuna de AZ y 12 con la de PF. 153 (91,6 %) participantes en la encuesta reconocieron haber experimentado síntomas compatibles con la reactividad a la vacuna administrada, 122 (93,1 %) fueron mujeres y 31 (86,1 %) hombres, p=0,178.
Los efectos adversos manifestados se presentan en la tabla 2. Se señalan en negrita los que afectaron a más del 50 % de los participantes.
Tabla 2. EA manifestados por los participantes en la encuesta y su duración
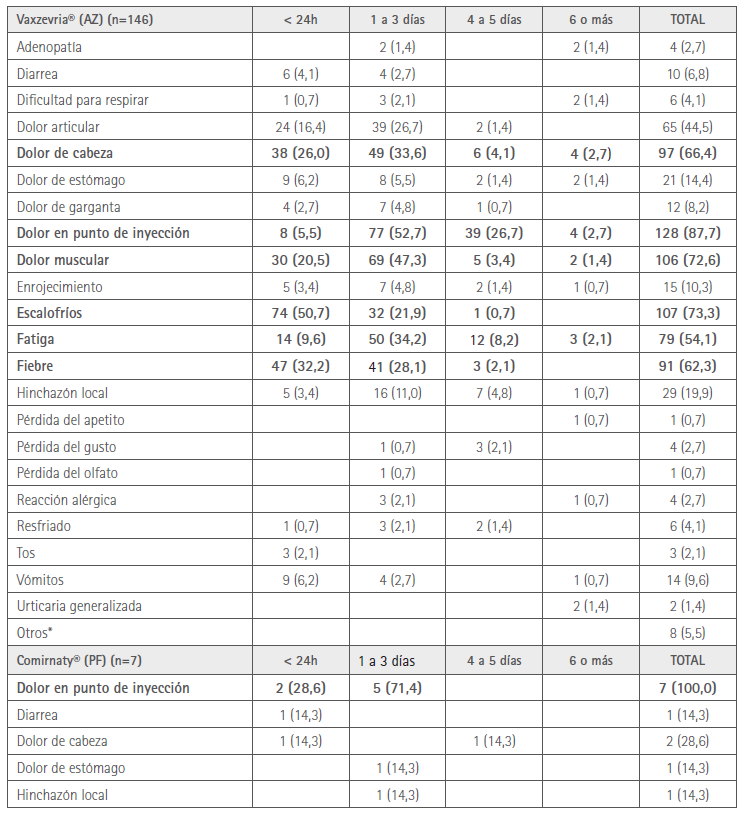
* 2 náuseas; 2 dolor axilar, hipotensión, espasmo ocular, insomnio, reflujo, que no indicaron duración de los mismos.
Figura 2. Distribución del número de EA manifestados por los participantes en la encuesta
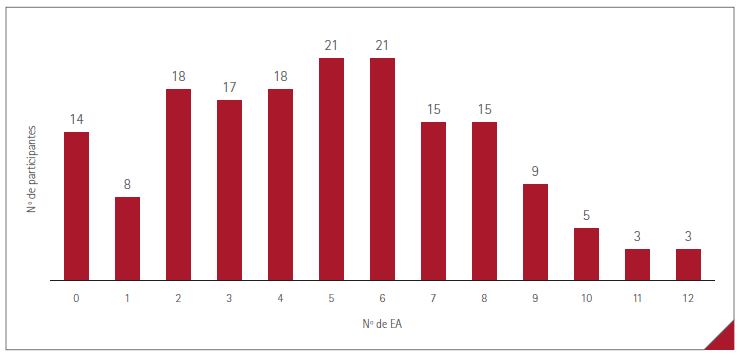
Con Vaxzevria® el promedio de EA por paciente fue de 5,3 (DE=2,8, rango= 0-12) y con Comirnaty® de 0,9 (DE=1,0, rango= 0-3 por paciente). La distribución del número de EA manifestados por los participantes en la encuesta se muestra en la figura 2.
De los 153 vacunados que tuvieron EA, 132 (86,3 %) necesitaron medicamentos para aliviar los síntomas de las reacciones experimentadas: 106 mujeres, el 86,9 %, de las que sufrieron EA y 26 hombres, el 83,9 % de estos. El medicamento más utilizado fue paracetamol, por 116 participantes. En 86 casos solo paracetamol, en 21 además necesitaron ibuprofeno y en 1 naproxeno. Recurrieron a un antiinflamatorio no esteroideo en 37 ocasiones, en 11 de ellas solo ibuprofeno. Otros analgésicos, antieméticos y probióticos en 3 casos cada uno, cetirizina, equinácea, oscillococcinum y vitaminas en 1. Una participante, con antecedentes de alergia a medicamentos, necesitó metilprednisolona 60 mg + dexclorfeniramina 5 mg por vía intravenosa en el momento de la administración de la vacuna y prednisona 30 mg/12 h durante 3 días.
77 (46,1 %) participantes en la encuesta (68, el 51,9 % de las mujeres y 9, el 29,0 % de los hombres), no pudieron desarrollar con normalidad sus actividades diarias habituales. 47 (28,1 %) participantes (41, el 31,3 % de las mujeres y 6, el 19,4 % de los hombres) no pudieron acudir a su puesto de trabajo el día siguiente.
Relaciones entre variables
La relación entre variables se analizó únicamente con respecto a la vacuna de AZ, pues el pequeño número de vacunados con la de PF no permitió el análisis. No se encontró relación entre la aparición del conjunto de EA y el sexo o la edad. Sí en el caso de algunos EA concretos y el sexo (tabla 3).
Tabla 3. Relación entre sexo y reacciones con significación estadística
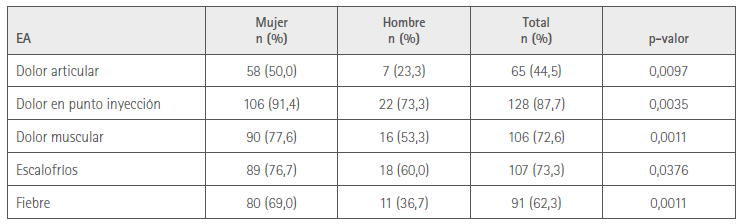
Los porcentajes se refieren al número de personas del mismo sexo participantes en la encuesta.
A 65 (56,0 %) mujeres y 8 (26,7 %) hombres los EA les impidieron hacer su actividad habitual diaria, p<0,05. No hubo diferencias significativas entre sexos en cuanto a la actividad laboral, ni entre edades en cuanto a las actividades habituales ni laborales.
DISCUSIÓN
Se obtuvieron 167 formularios, lo que corresponde aproximadamente al 10 % del personal ejerciente en las farmacias de la provincia de Pontevedra vacunado con la primera dosis de las vacunas Vaxzevria® y Comirnaty®. La distribución por sexo y edad coincide con la existente en este colectivo (11).
Consideramos una limitación el posible sesgo que puede haber en cuanto a la participación. Al ser la respuesta voluntaria y tener que buscar el formulario en la página web del COFPO, los participantes tenían que estar especialmente motivados, posiblemente por haber experimentado reactividad y, por lo tanto, el número de EA comunicados puede no corresponderse con su prevalencia real. Por otro lado, la diferente edad y proporción de vacunados con una u otra vacuna resta significatividad a las posibles comparaciones entre ambas.
No hemos encontrado ningún estudio similar, en que se analicen los EA y la repercusión laboral y personal de las vacunas notificados por los profesionales de las farmacias comunitarias por SARS-CoV-2, con el que poder comparar nuestros resultados.
Más del 90 % de los participantes reconocieron haber sufrido al menos un EA, proporcionalmente más entre los que recibieron AZ (95 %) que PF (54 %). Aunque esta diferencia presenta significación estadística, no nos atrevemos a considerarla clínicamente relevante por la limitación ya señalada, pero sí representativa tanto de la vacuna recibida como del tramo etario en que se administró (1,3).
Los EA más frecuentes referidos por los participantes son dolor en el punto de inyección (88 % con AZ y 100 % con PF), escalofríos (73 % con AZ), dolor muscular (73 % con AZ), dolor de cabeza (66 % con AZ y 29 % PF) y fiebre (62 % con AZ). Todos ellos son recogidos entre los más frecuentes en las fichas técnicas y en otros informes (1,3,12-14), aunque en posiciones que no coinciden en todos los casos. El dolor en el punto de inyección es la reacción más frecuente para ambas vacunas también en las referencias, pero el segundo lugar en nuestro estudio (cefalea con PF y escalofríos con AZ) no coincide (1,3,12-14).
En general, todos los EA referidos fueron de intensidad leve o moderada y se resolvieron en un período de tiempo breve, tal como sucede en el estudio de Álvarez et al. (15). Por otro lado, la menor reactogenicidad que se observa entre los vacunados con PF que, pese a la reducida muestra, sugieren los resultados, puede asociarse a que fue administrada a mayores de 55 años, tal como se recoge en las fichas técnicas y otros estudios sobre seguridad de estas vacunas.
Se destaca también que en la vacuna de AZ la duración de los EA parece ser mayor que con la vacuna de PF, pudiendo presentar una duración superior a los 6 días. Es habitual que los participantes que reciben la vacuna de AZ experimenten más de una reacción al mismo tiempo, siendo frecuente que manifiesten entre 5 y 6 EA simultáneamente, pudiendo ser debido a una elevada reactogenicidad frente a la vacuna de los participantes como consecuencia de su edad menor de 55 años.
El porcentaje de mujeres que manifestaron haber sufrido al menos un EA es mayor que el de hombres (93 % frente a 86 %) coincidiendo con otros informes (13,15,16), aunque en nuestro estudio no hubo diferencias estadísticamente significativas en el número total de EA en relación con el sexo. Sin embargo, sí hubo diferencias para algunos EA concretos, en los que las mujeres refirieron mayor reactogenicidad. Igualmente, más mujeres necesitaron medicamentos para aliviar las molestias provocadas por los EA, sufrieron un mayor impacto sobre su actividad diaria (diferencias que resultaron significativas) y no pudieron acudir a su puesto de trabajo, lo que afectó a casi un tercio del personal facultativo y auxiliar y tuvo un considerable impacto al no haberse escalonado adecuadamente la administración de las vacunas.
Como se ha comentado, el reducido tamaño de la muestra no permite establecer conclusiones categóricas. No obstante, los resultados obtenidos dan una idea general sobre el perfil de seguridad de las vacunas administradas al colectivo de ejercientes en las farmacias comunitarias de la provincia de Pontevedra. Consideramos que el número de EA comunicados fue elevado y, aunque no fueron graves, afectaron de manera considerable a su actividad diaria, personal y laboral. Pese a ello el balance beneficio/riesgo es enormemente positivo y los farmacéuticos comunitarios y sus colaboradores continúan prestando un servicio fundamental a la población que ha sido ampliamente reconocido.
REFERENCIAS BIBLIOGRÁFICAS
1. Agencia Europea del Medicamento. Ficha técnica Comirnaty®. [Acceso 22/10/21]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_es.pdf
2.Agencia Europea del Medicamento. Ficha técnica Spikevax®. [Acceso 22/10/21]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/spikevax-previously-covid-19-vaccine-moderna-epar-product-information_es.pdf
3. Agencia Europea del Medicamento. Ficha técnica Vaxzevria®. Actualizado 22/10/2021. [Acceso 22/10/21]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product-information_es.pdf
4. Ministerio de Sanidad. La AEMPS lanza una campaña sobre las garantías de las vacunas frente a la COVID-19. [Nota informativa]. 21/12/2020. [Acceso 27/10/21]. Disponible en: https://www.aemps.gob.es/informa/notasinformativas/laaemps/2020-laaemps/la-aemps-lanza-una-campana-sobre-las-garantias-de-las-vacunas-frente-a-la-covid-19/
5. Polack F, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383:2603-15. doi:10.1056/NEJMoa2034577.
6. Anderson EJ, Rouphael NG, Widge AT, Jackson LA, Roberts PC, Makhene M, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020;383:2427-38. doi:10.1056/NEJMoa2028436
7. Voysey M, Costa Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomized controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397(10269):99-111. doi:10.1016/S0140-6736(20)32661-1
8. Ministerio de Sanidad. Vigilancia de la Seguridad de las vacunas frente a la COVID-19 V-7. Actualizado 25/1/2021. [Consultado 27/ 10/2021]. Disponible en: https://www.aemps.gob.es/medicamentos UsoHumano/vacunas/docs/vigilancia_seguridad_vacunas_COVID-19.pdf?x54046&x95597
9.Consellería de Sanidade. Plan galego de vacinación fronte ao SARS-CoV-2. Versión 3.0. 19/2/2021. Santiago de Compostela: Consellería de Sanidade; 2021.
10. Grupo de Trabajo Técnico de Vacunación COVID-19, de la Ponencia de Programa y Registro de Vacunaciones. Ministerio de Sanidad. Estrategia de vacunación frente a COVID-19 en España. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/Actualizaciones_Estrategia_Vacunacion/docs/COVID-19_Actualizacion3_EstrategiaVacunacion.pdf
11. Consejo General de Colegios Oficiales de Farmacéuticos. Estadísticas de Colegiados y Farmacias Comunitarias 2020. [Acceso 21/10/21]. Disponible en: https://www.farmaceuticos.com/wp-content/uploads/ 2021/09/Estadisticas-Colegiados-y-Farmacias-2020.pdf
12. Ministerio de Sanidad. Centro de Coordinación de Alertas y Emergencias Sanitarias. Información sobre la inmunidad y el desarrollo de vacunas frente a COVID-19. Actualización, 20/05/2021. [Acceso 24/10/2021]. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/20210520_INMUNIDAD_Y_VACUNAS.pdf
13. Ministerio de Sanidad. 9º Informe de Farmacovigilancia sobre Vacunas COVID-19. 20/10/2021. [Acceso 29/11/2021]. Disponible en: https://www.aemps.gob.es/informa/boletines-aemps/boletin-fv/2021 -boletin-fv/9o-informe-de-farmacovigilancia-sobre-vacunas-covid-19/
14.Amanzio M, Mitsikostas DD, Giovannelli F, Bartolia M, Cipriani GE, Brown WA. Adverse events of active and placebo groups in SARS-CoV-2 vaccine randomized trials: A systematic review. Lancet Reg Health Eur. 2022;12:100253. doi:10.1016/j.lanepe.2021.100253
15. Álvarez Collado L, Castiñeiras Ortega M, González Contreras F, González de Abreu JM, Casma López RM, Núñez López MC. Reacciones adversas notificadas tras la administración de vacuna frente a Covid-19 en trabajadores de un hospital terciario. Rev Asoc Esp Espec Med Trab. 2021;30(2):227-38. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1132- 62552021000200217
16. Menni C, Klaser K, May A, Polidori L, Capdevila J, Panayiotis L, et al. Vaccine side-effects and SARS-CoV-2 infection after vaccination in users of the COVID Symptom Study app in the UK: a prospective observational study. Lancet Infect Dis. 2021;21:939-49. doi:10.1016/S1473-3099(21)00224-3
Editado por: © SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria.
© Copyright SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria. Este trabajo está bajo la licencia internacional Creative Commons Atribución/Reconocimiento-NoComercial 4.0. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc/4.0/deed.es


