- La revista
- nike air jordan 1 mid outlet
- Кросівки nike air max correlate (оригінал, 39 р). — цена 750 грн в каталоге Кроссовки ✓ Купить женские вещи по доступной цене на Шафе, Украина #109005122 , nike kyrie 1 easter on feet images and names free
- Manor PHX – Cheap Ietp Jordan Outlet , Костюм спортивний adidas Eqt , Premium Footwear & Streetwear Boutique
- Кроссовки nike lunar forever 4 msl оригинал 37р - mens maroon and gold nike clothes , Украина #38216599 - 24см — цена 450 грн в каталоге Кроссовки ✓ Купить женские вещи по доступной цене на Шафе
- air jordan 1 low outlet
- adidas y 3 qasa high triple black
- nike dunk low university blue
- air jordan release dates
- Gnarhunters Nike SB Dunk Low DH7756 010 Release Date On Foot
- buy nike dunk low purple pulse dm9467 500 shoes online
- Presentación
- Políticas y proceso editorial
- Rigor científico y metodológico
- Producción y Administración
- Comités
- Normas presentación
- Consideraciones eticas
- Enviar artículo
- Hemeroteca
- Indexación
- Buscar
- Contacto
Farm Comunitarios. Próximamente 2024. doi: 10.33620/FC.2173-9218.(2024).15
Capacidad de penetración y efecto antiinflamatorio local de un gel de salicilato de metilo con esencia de trementina, alcanfor y mentol para el tratamiento local sintomático de dolores musculares y articulares
INTRODUCCIÓN
La respuesta inflamatoria es una reacción compleja del sistema inmunitario ante cualquier agresión a las células o tejidos, ya sea por agentes biológicos, sustancias químicas, estímulos físicos o estímulos mecánicos. Sus síntomas incluyen dolor, calor, rubor, tumefacción y una disminución de la funcionalidad del área afectada. Dado su carácter generalizado, la inflamación se clasifica como una manifestación de la inmunidad innata por su naturaleza no específica, en contraste con la inmunidad adaptativa con capacidad de reconocer y responder de manera específica a cada tipo de patógeno (1). El proceso inicial de la inflamación es la irritación, una condición inflamatoria o reacción dolorosa frente a alergias o daño celular. El estímulo o agente que desencadena el proceso se conoce como agente irritante, y pueden ser compuestos químicos, pero también estímulos mecánicos, térmicos o radiactivos (2).
La irritación cutánea comprende diversos eventos que conducen a una respuesta inflamatoria en el lugar de la exposición. Las citocinas, constituidas por proteínas y glicoproteínas, son esenciales en la modulación de la respuesta inflamatoria e inmune. Se ha identificado a las células epidérmicas como principales productoras de estas moléculas, las cuales, en su calidad de mediadores químicos, son liberadas durante el proceso inflamatorio para amplificar y diseminar la respuesta inflamatoria (2). Dentro del amplio espectro de citocinas, el factor de necrosis tumoral alfa (TNF-α) sobresale por su relevancia en la inflamación sistémica y en la reacción de fase aguda, ejerciendo funciones críticas en la regulación de células inmunitarias, inducción de fiebre, apoptosis, caquexia, inhibición de la génesis tumoral y replicación viral en respuesta a sepsis, interaccionando con células productoras de IL-1 e IL-6 (3). Por otro lado, la interleucina 1 alfa (IL-1α), también denominada hematopoyetina 1, es una citocina inflamatoria potente que desencadena la inflamación, y su desregulación puede resultar en inflamación aguda o crónica severa (4). La interleucina 1 beta (IL-1β), por su parte, actúa como una citocina proinflamatoria clave en la respuesta inmune ante infecciones y lesiones (5) y la interleucina 6 (IL-6) interviene en procesos fisiológicos esenciales como la respuesta de fase aguda, la diferenciación y activación de células B y T, y el mantenimiento de la viabilidad celular (6). Asimismo, la interleucina 8 (IL-8), liberada por fagocitos y células tisulares en respuesta a estímulos inflamatorios, es un agente quimioatrayente primario para los neutrófilos (7).
Finalmente, el factor nuclear kappa B (NF-κB) juega un papel crucial en la regulación de la transcripción del ADN, la producción de citocinas y la supervivencia celular, respondiendo a estímulos variados como citocinas, radicales libres, metales pesados, radiación ultravioleta, LDL oxidado y antígenos bacterianos o virales (8,9).
La complejidad del papel de estas moléculas en el proceso inflamatorio es notable, ya que no solo modulan la actividad y función de otras células, sino que también coordinan y controlan la respuesta inflamatoria de manera precisa. Se ha propuesto que las citocinas y quimiocinas pueden interactuar con los nervios sensoriales, a través de la activación de receptores de alta afinidad, lo que sugiere un mecanismo por el cual podrían influir en la sensación de dolor y en la perpetuación del estado inflamatorio (10,11).
Los antiinflamatorios no esteroideos (AINE) orales constituyen uno de los pilares fundamentales en el manejo del dolor musculoesquelético. Sin embargo, pese a su eficacia, la administración de AINE por vía oral o parenteral frecuentemente se asocia a efectos secundarios como erosiones de la mucosa y hemorragia gastrointestinal que la mayoría de veces cursan de forma asintomática y se resuelven espontáneamente (12). Por ello, los antiinflamatorios tópicos se plantean como una alternativa válida en el manejo del dolor articular y a menudo se considera la opción más adecuada para determinados pacientes.
Los tratamientos tópicos pueden llegar a proporcionar un efecto analgésico equivalente al de los tratamientos orales. Sin embargo, la piel por su compleja arquitectura estratificada plantea un reto importante para la penetración eficaz de los fármacos (13). El estrato córneo (EC) actúa de barrera externa de la piel que dificulta la penetración y difusión hacia la epidermis y la dermis de cualquier fármaco aplicado tópicamente (14). Este freno generalmente conlleva que, más allá del EC, sólo se alcance una concentración activa mínima, un fenómeno que usualmente motiva la incorporación de potenciadores de la permeación cutánea (PPC) para fortalecer el paso transdérmico del fármaco. Tras alcanzar el lugar de acción, el fármaco debe mantenerse en una concentración óptima para disminuir eficazmente la síntesis de prostaglandinas, reduciendo así la inflamación y el dolor. Se postula que, en estados inflamatorios agudos, los AINE tópicos ejercen su efecto primordialmente a través de la atenuación local de los síntomas, más allá de su absorción sistémica. Los estudios han demostrado que las concentraciones tisulares de AINE tópicos alcanzan niveles eficaces capaces de inhibir selectivamente la ciclooxigenasa-2 (15,16), mientras que las concentraciones plasmáticas resultantes representan solo una mínima fracción (generalmente inferior al 5 %), limitando así los efectos adversos sistémicos.
El salicilato de metilo (SM) es un éster del ácido salicílico (AS), que a su vez es el principal metabolito activo del ácido acetilsalicílico o aspirina, considerado como el primer fármaco antiinflamatorio no esteroideo (AINE). La aspirina, sintetizada por primera vez a finales de la década de 1890, presenta propiedades antiinflamatorias, analgésicas y antipiréticas por inhibición de la ciclooxigenasa, y desde sus inicios se popularizó como analgésico oral. El desarrollo farmacéutico posterior fue el que condujo al uso medicinal de los salicilatos para su aplicación cutánea, concretamente el uso tópico del ácido salicílico (AS) por su efecto queratolítico, antimicrobiano y fotoprotector; y del SM principalmente para el tratamiento del dolor musculoesquelético, contribuyendo de forma eficaz al manejo del dolor a lo largo de los años (13,17).
Los beneficios terapéuticos del SM son el resultado de su acción multimodal que incluye el incremento de la temperatura local de la piel y una mejora en la circulación sanguínea, esenciales para el alivio sintomático y la aceleración del proceso curativo. El SM tópico está indicado como analgésico y antiinflamatorio (generalmente en una concentración del 10 al 30 %) (13). Presenta una alta afinidad lipofílica, lo que le permite atravesar la barrera cutánea, transformándose rápidamente, mediante hidrólisis por esterasas, en ácido salicílico tanto en la epidermis como en la dermis para lograr una acción analgésica (15).
Se ha comercializado una presentación en forma de gel de un medicamento tópico a base de salicilato de metilo, esencia de trementina, alcanfor y mentol, indicado en el alivio local sintomático de dolores musculares y articulares (18).
El objetivo del estudio fue, por una parte, determinar la capacidad de penetración del SM en la piel vehiculizado en forma de gel (GelSMETAM) y por otra, confirmar su eficacia antiinflamatoria al ser administrado por esa vía.
MATERIAL Y MÉTODOS
Se ha evaluado la capacidad de penetración cutánea de GelSMETAM y su efecto antiinflamatorio en explantes de piel humana, que incluían epidermis y dermis superior, obtenidos de donantes que firmaron un consentimiento informado y permitieron el uso de estos explantes para fines de I+D y empíricos.
Estudio de capacidad de penetración cutánea (19)
Se realizaron tres réplicas explantes con 3 réplicas técnicas cada una. Los explantes se ubicaron en una celda
Franz estática a una temperatura constante de 32 ± 1 ºC durante 20 minutos para alcanzar el equilibrio con el fluido receptor. A continuación, se aplicó GelSMETAM en la piel con una concentración de SM de 22.000 ng/mg de producto (cantidad total: 79.200 ng de SM y 3,6 mg de producto), seguido de una incubación de 12 horas. Se tomaron muestras de fluido receptor en intervalos de 0, 1, 4, 8 y 12 horas, y se procedió a la cuantificación de los niveles de salicilato de metilo mediante cromatografía líquida con espectrometría de masas (LC-MS/MS). El análisis se llevó a cabo utilizando un sistema LC-MS/MS Qtrap 6500 plus de Sciex, con columnas analíticas Acquity C18 BEH (1,7 μm; 50 x 2,1 mm) a una temperatura de 35 ºC.
Estudio de eficacia antiinflamatoria
Los explantes de piel humana se sometieron a un impacto significativo, consistente en dejar caer un bloque de metal de 1 kg desde una altura de 30 cm. Inmediatamente después de este evento, se aplicó GelSMETAM sobre la piel. Posteriormente, los explantes fueron procesados para analizar la expresión génica de factores clave, como TNFα, IL-1α, IL-1β, IL-6, IL-8, NF-κB, y COX-2 en tres intervalos de tiempo de incubación (30 minutos, 8 horas y 12 horas), mediante la técnica de reacción en cadena de la polimerasa cuantitativa en tiempo real (qRT-PCR). La extracción del ARN total se realizó utilizando el kit RNeasy de Qiagen, seguido de un tratamiento con DNAsa-I para eliminar posibles contaminaciones de ADN genómico. La calidad y cantidad del ARN se verificaron empleando un espectrofotómetro Nano-Drop, y se utilizaron 500 ng de ARN total para llevar a cabo la síntesis de cDNA con el kit de primera hebra de TaKaRa. Finalmente, se llevó a cabo una PCR cuantitativa (qPCR) en una máquina de PCR en tiempo real (QuantStudio 5, Applied BioSystem), utilizando el gen β-ACT como gen de referencia para la normalización de los datos. Para cada intervalo de incubación, la qRT-PCR se estableció en 3 réplicas biológicas con 3 réplicas técnicas cada una.
Se incorporó en el estudio un grupo de control sin tratamiento GelSMETAM utilizando tres explantes de piel humana distintos, obtenidos de diferentes voluntarios, como tres repeticiones biológicas. Cada explante se dividió en tres secciones para abordar las repeticiones técnicas.
Métodos estadísticos
Los resultados obtenidos se sometieron a un análisis estadístico mediante un ANOVA de una vía. Para evaluar la significancia, se aplicó un intervalo de confianza del 95 %, considerando significativo un valor de p<0,05.
RESULTADOS
Estudio de capacidad de penetración cutánea
El análisis mediante LC-MS/MS en el fluido receptor, detectó dos picos de SM, uno a los 5,2 minutos (tiempo de retención), que con el tiempo desaparece y otro nuevo que se forma a los 4,8 minutos, lo que sugiere que esa forma de la sustancia se transforma o degrada. Los resultados de penetración mostraron que aproximadamente el 0,8 % del salicilato de metilo total aplicado penetró en la piel. El aumento de la concentración de SM fue dependiente del tiempo para ambos picos (figura 1), con un flujo de penetración calculado de 53,2 ± 4,0 ng/cm2*h.
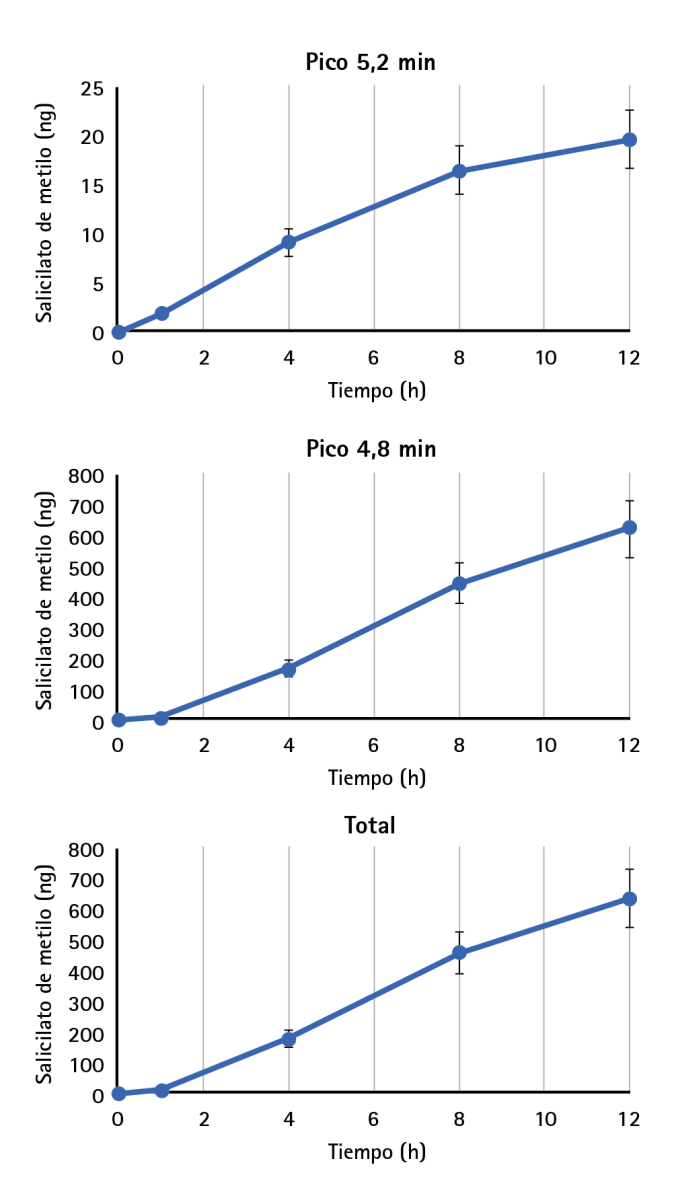
Figura 1 Salicilato de metilo total (ng) durante el tiempo de muestreo de 12 h del fluido receptor en el sistema de células de difusión Franz tras la aplicación de GelSMETAM en explantes de piel humana. Se aplicó un total de 79.200 ng de salicilato de metilo a los explantes de piel humana, siendo aproximadamente el 0,8 % de producto el que penetró en la piel humana
Estudio de eficacia antiinflamatoria
Los resultados a los 30 minutos mostraron que el impacto aumentó significativamente los niveles de expresión génica de TNFα, IL1α, IL6, IL8, NFKβ e IL1β en comparación con el control. En cambio, en las muestras tratadas con GelSMETAM, la expresión génica de TNFα, IL1α, IL6, IL8 y NFKβ se redujo significativamente en comparación con las muestras impactadas no tratadas (figura 2a). También se analizaron los niveles de expresión génica de la COX-2 en las muestras tratadas y no tratadas con GelSMETAM, pero no se detectaron aumentos significativos como consecuencia del impacto en ninguna de ellas.
A las 8 horas del impacto, los niveles de expresión de los genes TNFα, IL1α, IL6, IL8, NFKβ e IL1β seguían presentado un aumento significativo respecto al control mientras que, en las muestras tratadas con GelSMETAM, ese incremento de expresión génica se redujo significativamente (figura 2b). A las 12 h tras el impacto, la expresión génica de IL1α aún seguía estando significativamente elevada respecto al control. Sin embargo, al igual que en los intervalos de tiempo anteriores, su incremento se vio significativamente reducido en un 69,4 % en la muestra tratada con GelSMETAM (figura 2c).
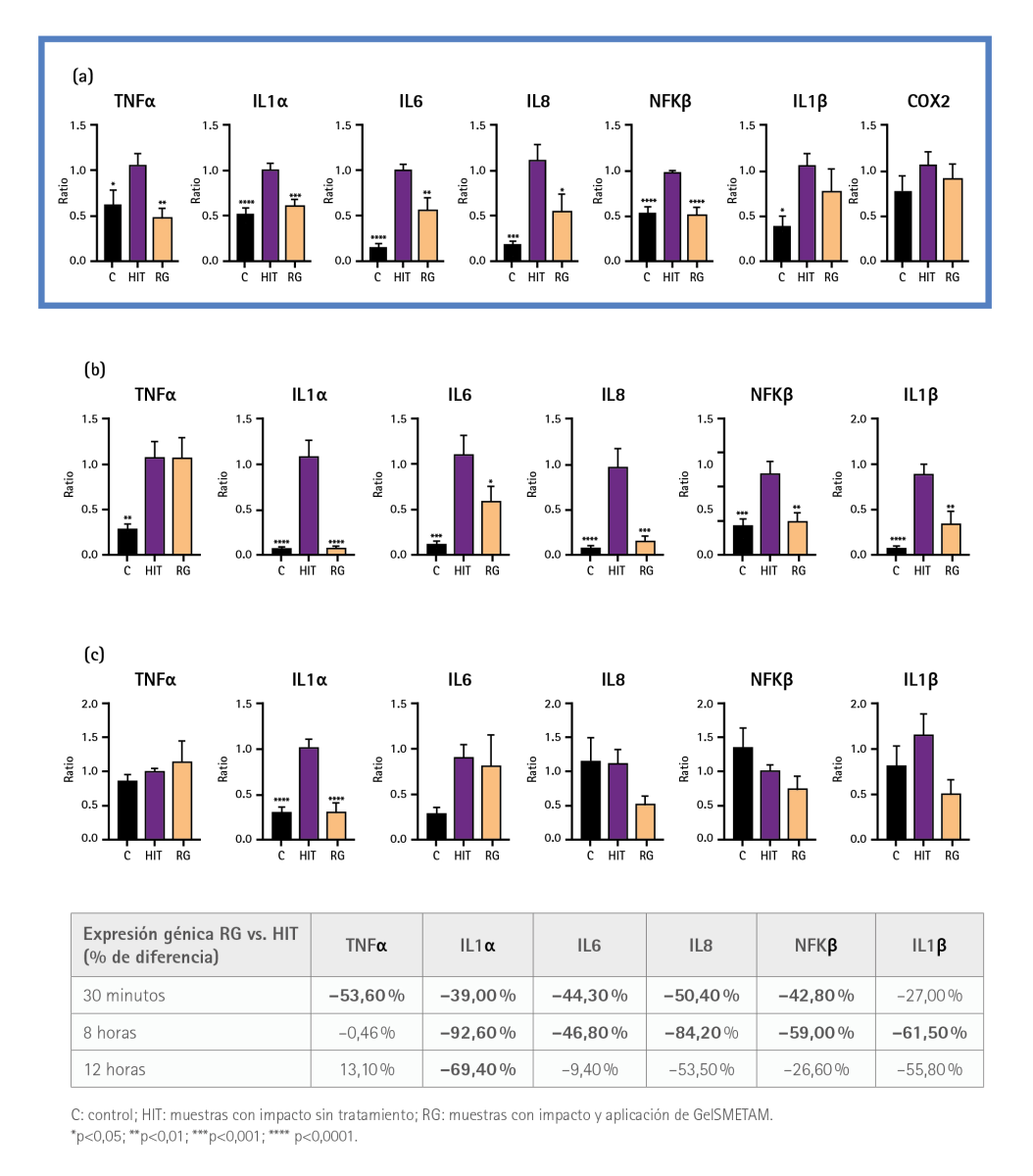
Figura 2 Análisis de la expresión génica mediante qRT-PCR. Aumento en la expresión génica de TNFα, IL-1α, IL-6, IL-8, NFKβ, IL-1β a diferentes intervalos de incubación tras el impacto: (a) 30 minutos, (b) 8 horas, (c) 12 horas
DISCUSIÓN
Los resultados de los estudios ex vivo con explantes de piel humana demuestran que la formulación del medicamento en forma de gel (GelSMETAM) alcanza unos niveles de penetración cutáneos del 0,8 % (de la concentración de SM) dependientes del tiempo, siendo estos niveles elevados si los comparamos con la penetración habitual de otros productos de absorción percutánea (20). Los resultados también muestran un efecto antiinflamatorio importante en los primeros 30 minutos que se prolonga a las 8 h de su aplicación con reducción significativa de la mayoría de las interleucinas y mediadores inflamatorios que se elevan en respuesta a una lesión (en este modelo de un impacto). Dicho efecto antiinflamatorio se prolonga incluso hasta las 12 h en el caso de la citocina IL1 que sigue persistiendo elevada tras el golpe sobre la muestra piel, a diferencia del resto de citocinas que a las 12 horas ya han disminuido mucho sus niveles tras la respuesta inicial.
El sistema de difusión en células de Franz se ha establecido como una metodología de investigación esencial para evaluar la permeabilidad cutánea y ofrecer información sobre la interacción entre la piel, los fármacos y sus formulaciones, así como la identificación de posibles toxicidades y la calidad de los productos (21). En este estudio la técnica de células de difusión de Franz se ha utilizado junto con el análisis cromatográfico acoplado a espectrometría de masas en tándem (LC-MS/MS), para la detección del salicilato de metilo, por ser el principio activo de GelSMETAM más estudiado.
Los resultados muestran que el SM se detecta a los 5,2 minutos, manifestándose como un pico característico en el tiempo de retención. No obstante, con el transcurso del tiempo, se evidencia una disminución progresiva de este pico, coincidiendo con la emergencia de un nuevo pico a los 4,8 minutos. Estos cambios sugieren la posible conversión del SM en ácido salicílico, principal metabolito en el proceso de degradación del SM, lo que sería esperable teniendo en cuenta que se trata de un fenómeno ya observado anteriormente en otros estudios (17,22).
Los resultados de la presente investigación muestran que un 0,8 % de la dosis total de SM aplicada logró atravesar la barrera epidérmica. Esta proporción de absorción representa un incremento en comparación con el 0,2-0,26 % documentado en estudios in vitro anteriores (20). Este hallazgo sugiere una mayor permeabilidad en los tejidos humanos que lo reportado previamente en la literatura, aunque esta divergencia podría ser debida a diferencias en las variables de los estudios, como por ejemplo el estado de hidratación de la piel o el resto de componentes de la formulación (23).
El SM se ha utilizado para tratar el dolor de tejidos blandos durante muchos años (13,16,24). Al igual que otros AINE, su acción farmacológica se basa en la supresión de la producción de sustancias proinflamatorias y en su actividad inhibitoria sobre la ciclooxigenasa que reduce la síntesis de prostaglandinas (PGE2) a partir del ácido araquidónico (24,25). Para este estudio, los efectos antiinflamatorios de GelSMETAM se evaluaron mediante el análisis de la expresión génica de citocinas proinflamatorias (qRT-PCR) en explantes de piel humana. Cuando se produce una irritación cutánea por cualquier tipo de estímulo, incluidos los mecánicos como el modelo utilizado para este estudio, se desencadenan diversos eventos que conducen al desarrollo de una respuesta inflamatoria en el lugar de exposición. Las citocinas actúan como mediadores químicos liberados durante el proceso, lo cual contribuye a intensificar y propagar la respuesta inflamatoria. Los resultados de esta investigación mostraron un aumento de la expresión génica de las citocinas proinflamatorias evaluadas en los explantes de piel tras ser sometidos a un golpe, validando así el impacto como modelo de evento capaz de desencadenar una reacción inflamatoria local en las muestras utilizadas. La disminución de la expresión génica de las citocinas proinflamatorias observada tras la aplicación de GelSMETAM, confirmó el efecto antiinflamatorio de este producto, cuyo principal componente con efecto antinflamatorio es el SM.
Es importante reconocer que, en este estudio, la ausencia de una respuesta de la COX-2 al experimento realizado (impacto sobre los explantes cutáneos) ha impedido evaluar el posible efecto inhibidor de GelSMETAM sobre la ciclooxigenasa. Sin embargo, a diferencia de la evidencia existente sobre la inhibición no selectiva de la COX1 y la COX2 por los salicilatos y sus derivados cuando se administran de forma sistémica, no parece haber ningún estudio que establezca una conexión entre el salicilato de metilo por vía tópica y las ciclooxigenasas.
Una limitación de este estudio es que, a pesar que los modelos ex vivo ofrecen un entorno controlado que permite un análisis detallado de los tejidos y células fuera del contexto del organismo completo, esta separación del entorno fisiológico natural podría afectar la extrapolación de los resultados a situaciones in vivo.
CONCLUSIONES
En conclusión, los resultados obtenidos en el estudio respaldan la hipótesis consistente en que la aplicación tópica de GelSMETAM proporciona una respuesta antiinflamatoria eficaz en el contexto clínico, ofreciendo una perspectiva interesante para el tratamiento de afecciones musculoesqueléticas, que podría limitar los eventos adversos sistémicos al maximizar la acción local y minimizar la biodisponibilidad sistémica del fármaco. Este trabajo posiciona a GelSMETAM como una opción adecuada para el manejo del dolor musculoesquelético. con menor riesgo de complicaciones gastrointestinales en comparación con los AINEs orales.
AGRADECIMIENTOS
Agradecemos a Bionos Biotech, laboratorio de bioensayos, su inestimable colaboración para la realización de los estudios de penetración y eficacia.
REFERENCIAS BIBLIOGRÁFICAS
1. Signore A. About inflammation and infection. EJNMMI. 2013;3 (1):8. doi:10.1186/2191-219X-3-8
2. Decean H, Perde-Schrepler M, Tatomir C, Fischer-Fodor E, Brie I, Virag P. Modulation of the pro-inflammatory cytokines and matrix metalloproteinases production in co-cultivated human keratinocytes and melanocytes. Arch Dermatol Res. 2013;305 (8):705-14. doi:10.1007/s00403-013-1353-6
3. Zelová H, Hošek J. TNF-α signalling and inflammation: Interactions between old acquaintances. Inflamm Res. 2013;62 (7):641-51. doi:10.1007/s00011-013-0633-0
4. Di Paolo NC, Shayakhmetov DM. Interleukin 1α and the inflammatory process. Nat Immunol. 2016;17 (8):906-13. doi:10.1038/ni.3503
5. Lopez-Castejon G, Brough D. Understanding the mechanism of IL-1β secretion. Cytokine Growth Factor Rev. 2011;22 (4):189-95. doi:10.1016/j.cytogfr.2011.10.001
6. Neurath MF, Finotto S. IL-6 signaling in autoimmunity, chronic inflammation and inflammation-associated cancer. Cytokine Growth Factor Rev. 2011;22 (2):83-9. doi:10.1016/j.cytogfr.2011.02.003
7. Bickel M. The role of interleukin-8 in inflammation and mechanisms of regulation. J Periodontol. 1993;64 (5 Suppl):456-60.
8. Perkins ND. Integrating cell-signalling pathways with NF-κB and IKK function. Nat Rev Mol Cell Biol. 2007;8 (1):49-62. doi:10.1038/nrm2083
9. Brasier AR. The NF-κB regulatory network. Cardiovasc Toxicol. 2006;6 (2):111-30. doi:10.1385/CT:6:2:111
10. Saika F, Kiguchi N, Kobayashi Y, Fukazawa Y, Kishioka S. CC-chemokine ligand 4/macrophage inflammatory protein-1β participates in the induction of neuropathic pain after peripheral nerve injury. Eur J Pain. 2012;16 (9):1271-80. doi:10.1002/j.1532-2149.2012.00146.x
11. Liou JT, Yuan HB, Mao CC, Lai YS, Day YJ. Absence of C-C motif chemokine ligand 5 in mice leads to decreased local macrophage recruitment and behavioral hypersensitivity in a murine neuropathic pain model. Pain. 2012;153 (6):1283-91. doi:10.1016/j.pain.2012.03.008
12. Tieppo Francio V, Davani S, Towery C, Brown TL. Oral Versus Topical Diclofenac Sodium in the Treatment of Osteoarthritis. J Pain Palliat Care Pharmacother. 2017;31 (2):113-20. doi:10.1080/15360288.2017.1301616
13. Anderson A, McConville A, Fanthorpe L, Davis J. Salicylate Poisoning Potential of Topical Pain Relief Agents: From Age Old Remedies to Engineered Smart Patches. Medicines. 2017;4 (3):48. doi:10.3390/medicines4030048
14. Lane ME. Skin penetration enhancers. Int J Pharm. 2013;447 (1-2):12-21. doi:10.1016/j.ijpharm.2013.02.040
15. Haroutiunian S, Drennan DA, Lipman AG. Topical NSAID therapy for Musculoskeletal pain. Pain Med. 2010;11 (4):535-49. doi:10.1111/j.1526-4637.2010.00809.x
16. Moore RA, Derry S, McQuay HJ. Topical agents in the treatment of rheumatic pain. Rheum Dis Clin North Am. 2008;34 (2):415-32. Disponible en: https://www.rheumatic.theclinics.com/article/S0889-857X(08)00023-9/abstract
17. Yeoh SC, Goh CF. Topical delivery of salicylates. Drug Deliv Transl Res. 2022;12 (5):981-1001. doi:10.1007/s13346-021-00988-5
18. Ficha técnica de Reflex® gel. [Última consulta 21 de Marzo de 2024].Disponible en: https://cima.aemps.es/cima/dochtml/ft/59479/FichaTecnica_59479.html
19. Bartosova L, Bajgar J. Transdermal drug delivery in vitro using diffusion cells. Curr Med Chem. 2012;19 (27):4671-7. doi:10.2174/092986712803306358
20. Cross SE, Megwa SA, Benson HAE, Roberts MS. Self promotion of deep tissue penetration and distribution of methylsalicylate after topical application. Pharm Res. 1999;16 (3):427-33. doi:10.1023/A:1018834021066
21. Ng SF, Rouse JJ, Sanderson FD, Meidan V, Eccleston GM. Validation of a static Franz diffusion cell system for in vitro permeation studies. AAPS PharmSciTech. 2010;11 (3):1432-41. doi:10.1208/s12249-010-9522-9
22. Telaprolu KC, Grice JE, Mohammed YH, Roberts MS. Human Skin Drug Metabolism: Relationships between Methyl Salicylate Metabolism and Esterase Activities in IVPT Skin Membranes. Metabolites. 2023;13 (8):934. doi:10.3390/metabo13080934
23. Yousef S, Mohammed Y, Namjoshi S, Grice J, Sakran W, Roberts M. Mechanistic Evaluation of Hydration Effects on the Human Epidermal Permeation of Salicylate Esters. AAPS J. 2017;19 (1):180-90. doi:10.1208/s12248-016-9984-0
24. Mao P, Liu Z, Xie M, Jiang R, Liu W, Wang X, et al. Naturally occurring methyl salicylate glycosides. Mini Rev Med Chem. 2014;14 (1):56-63. doi:10.2174/1389557513666131211110004
25. Patrignani P, Patrono C. Cyclooxygenase inhibitors: From pharmacology to clinical read-outs. Biochim Biophys Acta - Mol Cell Biol Lipids. 2015;1851 (4):422-32. doi:10.1016/j.bbalip.2014.09.016
Editado por: © SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria.
© Copyright SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria. Este artículo está disponible en la url https://www.farmaceuticoscomunitarios.org/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES


