- La revista
- DJ9292 , Dunk High Up Sail Sneakers , Nike AIR PEGASUS 83 PRM - 200 , IetpShops STORE
- air jordan outlet real
- adidas Basic Insulated Μπουφάν
- nike outlets have jordans
- IetpShops - Is a Nike SB x Air Jordan 8 Retro BG Three - 142 Pine Green in the Pipeline Low PSG DZ4133 , 008 Release Date - Is a Nike SB x Air Jordan 4 Pine Green in the Pipeline - Peat 305368
- air jordan 1 mid crater grey
- kids air jordan
- nike dunk low university blue
- adidas originals yeezy boost 350 v2 core blackred
- adidas Yeezy Boost 350 V2 Onyx HQ4540 Release Date On Foot
- Presentación
- Políticas y proceso editorial
- Rigor científico y metodológico
- Producción y Administración
- Comités
- Normas presentación
- Consideraciones eticas
- Enviar artículo
- Hemeroteca
- Indexación
- Buscar
- Contacto
Farm Comunitarios. 2022 Oct 21;14(4):27-33. doi: 10.33620/FC.2173-9218.(2022/Vol14).004.04
¿Puede el uso de enjuagues bucales con cloruro de cetilpiridinio reducir la transmisión del SARS-CoV-2?
INTRODUCCIÓN
El SARS-CoV-2, causante del síndrome respiratorio agudo severo o COVID-19 fue descrito por primera vez en diciembre de 2019 en Wuhan (China) (1) y ha provocado una epidemia mundial responsable de una afectación multiorgánica con elevada tasa de mortalidad y de secuelas en los supervivientes (2,3). A pesar de la eficacia de las vacunas y de la reciente comercialización de un tratamiento farmacológico que podrían mitigar la gravedad de la enfermedad (Paxlovid©), es necesario encontrar medidas preventivas que limiten la propagación y el contagio entre la población, y que puedan llevarse a cabo con facilidad y bajo coste económico.
Según las evidencias, este coronavirus se transmite principalmente a través de gotas respiratorias exhaladas al hablar, respirar, toser y estornudar, y podría propagarse por contacto entre objetos contaminados por estas gotitas y las mucosas del cuerpo (4). Por tanto, la cavidad oral actúa como un punto de entrada donde el virus se une a sus receptores de la enzima convertidora de angiotensina 2 (ACE-2), extendidos entre las glándulas salivares, lengua y mucosa oral (5).
Una vez dentro, el virus se acumula y replica en el tracto respiratorio superior, razón por la que se puede detectar una alta carga viral en la cavidad oral, nariz y orofaringe en pacientes afectados de COVID-19 (6). La última variante identificada, Ómicron, parece tener tropismo hacia la garganta y se detecta primeramente en la saliva (7). Además, la carga viral puede permanecer un tiempo prolongado en el esputo de pacientes infectados, ya que la saliva se ha establecido como un reservorio del virus en pacientes con sintomatología leve o incluso asintomáticos (8).
En vista de la importancia de la saliva en la transmisión de la enfermedad (1), la comunidad científica ha puesto el punto de mira de manera urgente en la higiene bucal, y ha buscado un método para disminuir la cantidad de SARS-CoV-2 en saliva, señalando el uso de enjuagues bucales que incluyen ciertos compuestos diana de la membrana lipídica externa del virus (9). Tanto estudios llevados a cabo in vitro, como en la práctica clínica, han puesto de manifiesto este efecto antiviral de algunos colutorios de uso cotidiano, los cuales contienen en su formulación antisépticos de amplio espectro. Entre ellos destaca el cloruro de cetilpiridinio (CPC), un derivado del amonio cuaternario muy usado como agente antimicrobiano, ya que interfiere con los componentes lipídicos de la superficie de bacterias, rompe la integridad de las envolturas de virus y destruye la cápside de la partícula viral debido a su acción lisosomotrópica (10). Ha mostrado actividad in vitro e in vivo frente a otros virus, como influenza, y varios coronavirus como MERS (11,12). Este compuesto químico está considerado como ‘seguro’ por la Food and Drug Administration (8), hallándose comúnmente en los colutorios medicinales a concentraciones de 0,02-0,075 % p/v.
Debido al reciente y precipitado interés en esta cuestión de salud pública, han ido apareciendo estudios relacionados con la potencial utilidad de los enjuagues bucales como profilaxis de la infección por SARS-CoV-2, existiendo a estas alturas de pandemia un amplio catálogo bibliográfico acerca de esta materia. Por lo tanto, el objetivo de este artículo es la selección de aquellos trabajos que permitan el análisis comparativo entre ellos, con el fin de extraer las conclusiones pertinentes acerca de su eficacia para romper la cadena de transmisión del SARS-CoV-2.
Material y métodos
En este trabajo se ha procedido a revisar la bibliografía de los estudios de investigación conducentes a evaluar el efecto antiviral del CPC con las siguientes características:
• Ensayos in vitro en distintas cepas conocidas de SARS-CoV-2 y muestras virales de hisopos nasofaríngeos positivos.
• Estudios clínicos en pacientes adultos con sintomatología clínica de COVID-19; muestras de saliva.
Los artículos seleccionados cumplían el criterio de tener como objetivo evaluar la disminución de la carga viral de SARS-CoV-2 por la acción de enjuagues con CPC a cualquier concentración, solo o asociado a otro antiséptico, frente a la no utilización de ningún enjuague bucal o placebo.
Para ello se han utilizado PubMed y Scopus como motores de búsqueda, y además se ha realizado una búsqueda manual en las listas de referencias de los artículos incluidos. La fecha final de búsqueda fue el 8 de abril de 2022.
Los descriptores o palabras clave usados para la búsqueda han comprendido los términos MeSH y libres: ‘cetylpyridinium chloride’, ‘mouthwash’, ‘mouth rinse’, ‘oral rinse’, ‘mouth bath’, ‘COVID-19’, ‘SARS CoV-2’, y ‘coronavirus’.
La estrategia de búsqueda empleada en PubMed y adaptada para Scopus ha sido: (COVID-19 OR SARS-COV-2 OR coronavirus) AND (‘’cetylpyridinium chloride’’ OR ‘’mouth rinse’’ OR ‘’mouth wash’’ OR mouthwash OR ‘’mouth bath’’), acotada a los últimos 5 años.
El proceso de selección de los artículos se llevó a cabo primero por título y abstract y, finalmente, mediante revisión del manuscrito completo. No se han incluido artículos de opinión, revisiones de otros estudios y estudios en animales, ni trabajos in vitro realizados con cepas de coronavirus animales y humanas distintas a la de SARS-CoV-2.
Resultados
La búsqueda de artículos en Pubmed dio lugar a 232 elementos. Tras la evaluación por título y abstract (screening) se seleccionaron 33 artículos (14,2 %). Mediante lectura completa se realizó la segunda evaluación (selección), tras la cual se excluyeron 2 estudios repetidos, 6 cartas al editor, 4 artículos de opinión y 8 con objetivo diferente, y se seleccionaron 12 artículos (36,4 %). La búsqueda en Scopus resultó en 51 artículos, cuya revisión no aportó ningún elemento seleccionado. Al realizar una búsqueda adicional de forma manual, se identificó 1 elemento. En total, se incluyeron 13 estudios en esta revisión, 10 ensayos in vitro y 3 ensayos clínicos (figura 1).
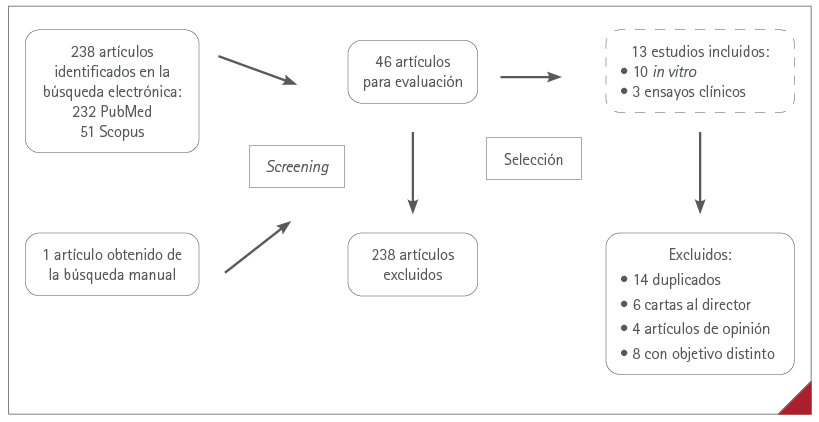
Figura 1 Esquema del proceso de revisión: identificación, primer screening por título y abstract, y selección de los estudios tras evaluación por lectura completa de los mismos
a) Estudios ‘in vitro’
Varios trabajos que evaluaron el CPC solo o en combinación con otros agentes reactivos respaldaron el efecto virucida de colutorios que contienen CPC, mostrando una alta reducción de la carga viral in vitro frente a distintas cepas de SARS-CoV-2. En un orden secuencial de antigüedad de los trabajos de menos a más reciente, se describen las siguientes publicaciones:
Statkute et al. (13) publicaron en un informe la actividad anti-SARS-CoV-2, evaluada en la cepa England 2 mediante el método de cuantificación de la acción antiviral EN14476, de colutorios con CPC a la concentración de 0,05 % y 1 % p/v. La incubación de las células infectadas con las formulaciones bucales se realizó en un medio imitando las condiciones de la mucosa oral, con secreciones salivares sintéticas, durante 30 segundos, tras lo cual los dos colutorios con CPC erradicaron el virus completamente, alcanzando títulos virales mínimos, sin provocar citotoxicidad.
Otro grupo de investigadores, Koch-Heier et al. (14), analizaron la eficacia antiviral del CPC en un estudio in vitro utilizando el método de ensayo de placa viral, donde las partículas infecciosas de la cepa FI-100 de SARS-CoV-2 se incubaron con las soluciones de: CPC al 0,05 %, una combinación de CPC al 0,05 % con clorhexidina 0,1 % y otra combinación de CPC 0,05 % más peróxido de hidrógeno 1,5 %, todas durante 30 segundos. Cuando se utilizó la combinación de CPC con peróxido de hidrógeno se redujo el título viral por debajo del límite de detección; combinado con clorhexidina también disminuyó significativamente, pero no por completo el número de placas virales respecto al medio control; y la fórmula de CPC al 0,05 % también tuvo actividad antiviral significativa, aunque se encontraron algunas placas virales. En ausencia de virus, los colutorios ensayados no mostraron efecto citotóxico.
Komine et al. (15) demostraron que enjuagues bucales comercializados en Japón, China, Europa y EE.UU. que contenían 0,04-0,075 % de CPC inactivaban más del 99,99 % de SARS-CoV-2 (cepa JPN/TY/WK-521) en 20-30 segundos, el tiempo que recomienda el fabricante mantener estos productos en la boca. Estos investigadores utilizaron el método estándar ASTM E1052-20 para evaluar la actividad microbicida frente a virus en suspensión, después de comprobar que los compuestos testados no tenían efecto citotóxico ni de interferencia.
Por su parte, Muñoz-Basagoiti et al. (16) investigaron el efecto antiviral de colutorios que contienen CPC al 0,05 y 0,07 % en las variantes D614G y B.1.1.7 (Alpha) de SARS-CoV-2, así como la capacidad de estos productos de higiene oral para inhibir la entrada de SARS-CoV-2 en las células diana con receptores ACE2 y su capacidad para reducir la infectividad provocada por las variantes. Los resultados obtenidos mostraron que la incubación de 2 minutos con CPC diluido directamente o en los enjuagues tiene actividad frente a las dos variantes de manera dosis-dependiente, y actúa suprimiendo la fusión viral al alterar la envoltura, inhibiendo así la entrada del virus en las células diana. En el ensayo en presencia de saliva esterilizada el CPC al 0,07 % (2mM) también consiguió reducir la infectividad viral (TCID50) más de mil veces en 30 segundos. Las concentraciones de CPC probadas no mostraron efectos citotóxicos en ninguno de los ensayos realizados.
Tiong et al. (17) ensayaron la actividad virucida de un producto de CPC al 0,075 % con 0,05 % de flúor en células Vero E6 infectadas experimentalmente con muestras virales de torundas naso/orofaríngeas, de individuos con resultado positivo mediante qPCR para SARS-Cov-2. La incubación a 30 segundos resultó en una inactivación de más del 99,99 %, de acuerdo con el protocolo estándar EN14476:2013/FprA1:2015, incluso en un medio con interferencia.
Rodríguez-Casanovas et al. (18) evaluaron la capacidad virucida de diferentes soluciones antisépticas con CPC: solo a concentraciones de 0,07 y 0,1 %, y combinado, al 0,12 % con 0,05 % de clorhexidina, al 0,075 % con 0,05 % de fluoruro de sodio, y al 0,05 % con 0,2 % de D-limoneno. Utilizaron hisopos nasofaríngeos positivos para SARS-CoV-2 mediante por RT-PCR, y las muestras virales se incubaron con los enjuagues bucales durante 1 minuto. Tras ese tiempo, se realizó un tratamiento con RNasa para degradar el ARN en caso de producirse actividad antiviral, y encontraron que sólo la suma de CPC y D-limoneno reducía la carga viral un 99,999 % en comparación con el control. Además, comprobaron la estabilidad del ARN viral que le confiere su envoltura frente a la digestión enzimática.
El trabajo de Anderson et al. (19) consistió en evaluar el efecto virucida del CPC al 0,07 % en células infectadas con las variantes de SARS-CoV-2, Alpha, Beta, Gamma y Delta, mediante el método estándar ASTM E1052-20. Al incubar durante 30 segundos, se encontró que la formulación de CPC redujo el título viral de las cuatro variantes por debajo del límite de detección, y que no provocó efecto citopático en las células. En presencia de saliva humana, mantuvo su capacidad para inactivar el virus por debajo del límite de detección, siendo tan eficaz como el etanol al 70 %.
Ramji et al. (20) también hallaron una actividad virucida potente de un enjuague bucal comercial con 0,07 % de CPC al incubar durante 30 segundos con una suspensión de la cepa USA-WA1/2020 del SARS-CoV-2, conforme al protocolo estándar europeo EN14476:2013+A2:2019. Para acurar las determinaciones utilizaron un agente neutralizante, y previamente realizaron ensayos de citotoxicidad usando varias diluciones en células VeroE6.
El trabajo de Okamato et al. (21) investigó el efecto anti-SARS-CoV-2 del CPC mediante un ensayo de placa viral en células VeroE6. La cepa procedía de un paciente que desarrolló COVID-19 en el barco Diamond Princess. Al incubar el virus con el CPC al 0,05 % durante 20 segundos el título viral se redujo un 91,9 %, mientras que la reducción fue mayor del 97 % a concentraciones de CPC de 0,1 % y 0,3. Además, evaluaron el efecto del CPC en la unión de la proteína (S) de la espícula viral y su receptor humano, la enzima convertidora de angiotensina 2 (ECA2), mediante ELISA, mostrando una reducción significativa de esta interacción al tratar con 0,05 y 0,3 % de CPC.
Buonavoglia et al. (22) ensayaron la actividad virucida de un colutorio con 0,01 % de CPC frente a la cepa salvaje de SARS-CoV-2, así como frente las variantes Alpha, Beta y Gamma. El resultado de la incubación durante 30 segundos mostró una reducción significativa del título viral en células VeroE6 respecto al control, tanto de la cepa salvaje como de las variantes, aunque la eficacia fue menor sobre la variante Gamma.
b) Ensayos clínicos
Los tres estudios recogidos relativos al tratamiento con CPC, se llevaron a cabo de forma aleatorizada, incluyendo a los sujetos sanos en grupos con igual tamaño de muestra. El grupo que utilizó el CPC en el primer estudio evaluó a 4 personas, el segundo a 12 y el tercero a 15. Estos dos últimos ensayos se realizaron en paralelo y a doble ciego. En dos de los estudios se hallaron resultados significativos, aunque débiles, en cuanto a la reducción de la carga viral de SARS-CoV-2 en la saliva de pacientes con prueba de la reacción en cadena de la polimerasa con reverso transcripción (RT-PCR) positiva al inicio del reclutamiento.
Seneviratne et al. (23) evaluaron la eficacia del CPC para reducir la carga viral de SARS-CoV-2 en la saliva de cuatro pacientes con COVID-19, mediante análisis RT-PCR del gen E del virus y medida de los valores del umbral de ciclos (Ct), que se consideran inversamente relacionados con la carga viral en la muestra. Las muestras de saliva se obtuvieron antes de usar el colutorio, y a los 5 minutos, 3 horas y 6 horas después de que los pacientes se aplicaran un enjuague bucal con CPC al 0,075 % durante 30 segundos. Al comparar los valores de Ct del análisis a cada tiempo post-colutorio con el valor obtenido antes del enjuague, se encontró un incremento significativo a los 5 minutos y 6 horas respecto el grupo control (con agua), aunque a las 3 horas también se hallaron valores de Ct más elevados que el control.
Los autores Eduardo et al. (24) indicaron que un colutorio con 0,075 % de CPC + 0,28 % de Zinc durante 30 segundos provoca una reducción significativa en la carga del virus SARS-CoV-2 en saliva hasta 60 minutos después del uso del enjuague. Para ello realizaron un estudio controlado con placebo (agua) para medir el umbral de ciclos (Ct) en el análisis RT-PCR del gen N del virus, a tiempo 0, inmediatamente después del enjuague, y 30 minutos y 60 minutos después. Los valores de Ct se elevaron inmediatamente y hasta 60 minutos después, comparado con el obtenido antes del enjuague, y el valor estadístico fue significativo en todos los tiempos.
En un estudio multicéntrico con una muestra de 84 pacientes, Ferrer et al. (25) evaluaron el efecto del CPC al 0,07 % sobre la carga viral en saliva al mantenerlo en la boca durante 1 minuto, mediante RT-qPCR, cuantificando así la carga viral antes del enjuague, y a los 30, 60 y 120 minutos después de utilizar el colutorio. Al comparar con los valores previos al enjuague, no se produjo un efecto significativo a ninguno de los tiempos, aunque el efecto máximo en la carga viral se observó 2 horas tras el tratamiento, con una reducción media en torno al 30 % e incluso del 50 % en el 59 % de los sujetos.
Los resultados de todos los estudios están resumidos en la tabla 1.
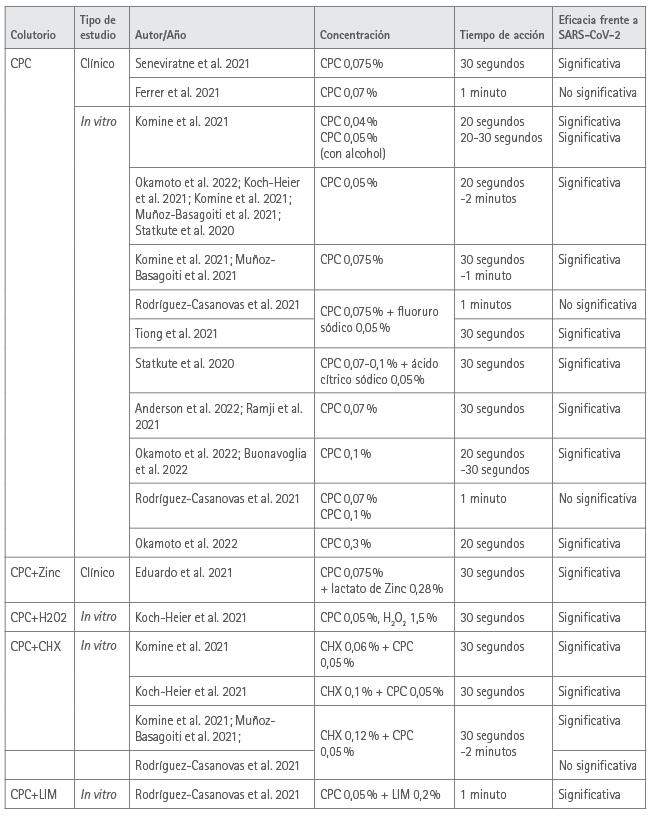
Tabla 1 Resumen de los trabajos de investigación sobre la eficacia de enjuagues bucales con CPC solo o en combinación frente al SARS-CoV-2 respecto al control
Discusión y conclusiones
Sin duda cabe decir que las investigaciones realizadas en laboratorio han permitido conocer la actividad inhibitoria de un antiséptico bucal de uso extendido, el CPC, sobre el agente infeccioso responsable de la COVID-19, el virus SARS-CoV-2. Casi todos los trabajos diseñados usando CPC a concentraciones de 0,04-0,3 % solo o en combinación mostraron resultados muy significativos, por lo que los autores pudieron concluir que los productos de cuidado oral que contienen CPC tienen actividad antiviral frente a SARS-CoV-2 in vitro; además, dedujeron el potencial del CPC, usándolo como parte de una buena rutina de higiene oral, para reducir la carga viral en la cavidad oral y mitigar la transmisión a través de las gotas de saliva (15,23). Incluso se ha propuesto que el uso de los enjuagues durante 1 o 2 minutos debería realizarse especialmente durante las primeras dos semanas de la infección, cuando los individuos son más contagiosos (19). La única excepción en la que el CPC no mostró acción virucida significativa a varias concentraciones fue la técnica bioquímica llevada a cabo por Rodríguez-Casanovas et al. (18); esto podría deberse a las limitaciones propias del diseño experimental. Mientras que Koch-Heier et al. (14) subrayan que la actividad virucida medida en el ensayo podría subestimar el efecto antiviral en la situación real, ya que el factor de dilución utilizado es mayor que la dilución del colutorio que se genera al entrar en contacto con la saliva en la boca mientras nos enjuagamos; por tanto, estos autores recomiendan el uso de colutorios con CPC en la práctica dental.
Respecto a los ensayos clínicos, parece haber contradicciones acerca del efecto virucida de este antiséptico oral, el CPC, ya que algunos autores encuentran una disminución de los niveles de SARS-Co-V-2 en saliva a los 5 minutos, que incluso se mantienen bajos hasta 6 horas después de la aplicación, respecto al grupo control (23). En otro estudio clínico mostrado, también aumentó de forma significativa el umbral de ciclos de la PCR para detectar el virus hasta 60 minutos después respecto al tiempo previo al enjuague (24); estos autores citan la falta de información sobre las condiciones orales de los pacientes que ingresan en el estudio como una cuestión a considerar. Sin embargo, otros investigadores (25) no obtuvieron un efecto significativo de los enjuagues orales con CPC sobre la carga viral del SARS-CoV-2 medida mediante qPCR, y juzgan la diferencia entre comparar los valores de carga viral con los niveles basales o confrontarlos respecto al placebo. En este estudio cabe destacar que hasta la mitad de los pacientes en el grupo de control disminuyó su carga viral en un 50 % después de 2 horas, lo que subraya la importancia del tamaño de muestra del control negativo, el cual debería ser equivalente al de los sujetos estudiados. Otra propuesta para esclarecer la eficacia del CPC ha sido el uso de un control positivo como los recién llegados medicamentos contra el SARS-CoV-2, que podrían ser adecuados para aplicación tópica a través de enjuagues bucales. Por otro lado, una hipótesis que explicaría por qué la actividad virucida del enjuague parece aumentar con el tiempo, se centra en la posibilidad de que aquellas partículas virales detectadas mediante RT-qPCR puedan ser inviables tras el tratamiento con enjuagues que contienen CPC. Por lo tanto, existe una necesidad urgente de hacer experimentos de cultivo viral con muestras de saliva recolectadas tras el uso del enjuague bucal para confirmar la viabilidad viral (25).
La concordancia entre los estudios in vitro-in vivo siempre supone un reto en investigación científica y existe la posibilidad de que las pruebas realizadas con los enjuagues bucales en laboratorio no puedan extrapolarse a las condiciones reales en la cavidad oral. Por ejemplo, algunos autores indican una menor disponibilidad del producto in vivo como consecuencia de la unión del antiséptico a otros microorganismos en la cavidad bucal, frente a los que también tienen actividad inhibitoria, incluidas las bacterias y/u hongos (25).
Para obtener una conclusión más precisa en cuanto a la eficacia de enjuagues bucales con CPC para mitigar el riesgo de transmisión de COVID-19, son necesarios nuevos estudios que proporcionen información acerca de la duración real de la actividad anti-SARS-CoV-2 en la cavidad oral, así como ensayos clínicos con un tamaño de muestra mayor y con distintos enfoques, como el estudio de la viabilidad viral, o estrategias que consideren el uso de CPC en spray nasal como otra medida de prevención (14,25). Por tanto, aunque las pruebas experimentales han mostrado que el potencial del CPC parece prometedor para reducir la carga del virus SARS-CoV-2, los resultados de los estudios indicados no son determinantes para señalar recomendaciones clínicas que aporten seguridad, por lo que actualmente las medidas de profilaxis frente al contagio deben limitarse principalmente a la higiene de manos, distanciamiento social y uso de mascarilla.
REFERENCIAS BIBLIOGRÁFICAS
1.Zhu N, Zhang D, Wang W Li X Yang B Song J et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019.N Engl J Med. 2020;382:727–73. doi:10.1056/NEJMoa2001017.
2. Hatmi ZN. A Systematic Review of Systematic Reviews on the COVID-19 Pandemic. SN Compr Clin Med. 2021;3:419–436. doi: 10.1007/s42399-021-00749-y. Epub 2021 Jan 26.
3.Suthar S, Das S, Nagpure A, Madhurantakam C, Tiwar SB, Gahlot P, Tyagi VK. Epidemiology and Diagnosis, Environmental Resources Quality and Socio-Economic Perspectives for COVID-19 Pandemic. J Environ Manag. 2021:280, 111700. doi:10.1016/j.jenvman.2020.111700.
4.Xu R, Cui B, Duan X, Zhang P, Zhou X, Yuan Q. Saliva: potential diagnostic value and transmission of 2019-nCoV. Int J Oral Sci. 2020; 12. doi:10.1038/s41368-020-0080-z.
5.Zou L, Ruan F, Huang M, Liang L, Huanh H, Hong Z, et al. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N Engl J Med. 2020; 382:1177-1179. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7121626/?report=reader .
6.Mendoza JP, Ubillús BP, Bolívar GT, Castañeda RP, Palacios PS, et al. Antiviral effect of mouthwashes against SARS- COV-2: a systematic review. Saudi Dent J. 2022. doi:10.1016/j.sdentj.2022.01.006.
7.Marais G, Hsiao N, Iranzadeh A, Doolabh D, Enoch A, Chu C, et al. Saliva swabs are the preferred sample for Omicron detection. MedRxiv preprint. doi:10.1101/2021.12.22.21268246
8.Carrouel F, Goncalves LS, Conte MP, Campus G, Fisher J, Fraticelli L, et al. Antiviral activity of reagents in mouth rinses against SARS-CoV-2. J Dent Res. 2021;100:124e32. doi:10.1177/0022034520967933.
9.Carrouel F, Valette M, Perrier H, Bouscambert-Duchamp M, Dussart C, Tramini P. Performance of self-collected saliva testing compared with nasophayngeal swab testig for the detection of sars-cov-2. Viruses. 2021;13:1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8150338/
10.Chen MH, Chang PC. The effectiveness of mouthwash against SARS-CoV-2 infection: a review of scientific and clinical evidence. Journal of the Formosan Medical Association 2021. doi:10.1016/j.jfma.2021.10.001
11.Popkin DL, Zilka S, Dimaano M, Fujioka H, Rackley C, Salata R, et al. Cetylpyridinium chloride (CPC) exhibits potent, rapid activity against influenza viruses in vitro and in vivo. Pathog Immun. 2017;2:252–269. Disponible en: https://www.paijournal.com/index.php/paijournal/article/view/200.
12.Shen L, Niu J, Wang C, Huang B, Wang W, Zhu N, et al. High-throughput screening and identification of potent broad-spectrum inhibitors of coronaviruses. J Virol. 2019; 93:e00023-19. doi:10.1128/JVI.00023-19.
13.Statkute E, Rubina A, O’Donnell VB, Thomas DW, Stanton RJ. Brief report: The virucidal efficacy of oral rinse components against SARS-CoV-2 in vitro. J Lipid Res. 2022;63(6):100208. doi:10.1016/j.jlr.2022.100208
14.Koch-Heier J, Hoffmann H, Schindler M, Lussi A, Planz O. Inactivation of SARS-CoV-2 through Treatment with the Mouth Rinsing Solutions ViruProX® and BacterX® Pro. Microorg. 2021;9(3):521. doi: 10.3390/microorganisms9030521
15.Komine A, Ymaguchi E, Okamoto N, Yamamoto K. Virucidal activity of oral care products against SARS-CoV-2 in vitro. J Oral Maxillofac Surg Med Pathol. 2021; 33: 475–77. doi:10.1016/j.ajoms.2021.02.002.
16.Muñoz-Basagoiti J, Perez-Zsolt D, León R, Blanc V, Raïch-Regué D, et al. Mouthwashes with CPC reduce the infectivity of SARS-CoV-2 variants in vitro. J Dent Res. 2021;100:1265–1272. doi: 10.1177/00220345211029269.
17.Tiong V, Hassandarvish P, Bakar SA, Mohamed NA, Wan Sulaiman WS, Baharom N, Abdul Samad FN, Isahak I. The effectiveness of various gargle formulations and salt water against SARS-CoV-2. Sci Rep. 2021;11(1):20502. doi:10.1038/s41598-021-99866-w.
18.Rodríguez-Casanovas H, De la Rosa M, Bello-Lemus Y; Rasperini G; Acosta-Hoyos A. Virucidal Activity of Different Mouthwashes Using a Novel Biochemical Assay. Healthcare (Basel). 2021;10(1):63. doi: 10.3390/healthcare10010063.
19.Anderson ER, Patterson EI, Richards S, Pitol AK, Edwards T, Wooding D, et al. CPC-containing oral rinses inactivate SARS-CoV-2 variants and are active in the presence of human saliva. J Med Microbiol. 2022:71. doi:10.1099/jmm.0.001508.
20.Ramji N, Circello B, Winston JL, Biesbrock AR. Virucidal Activity of Over- the-Counter Oral Care Products Against SARS-CoV-2. Oral Health Prev Dent. 2022;20(1):185-192. doi:10.3290/j.ohpd.b2960525.
21.Okamoto N, Saito A, Okabayashi T, Komine A. Virucidal activity and mechanism of action of cetylpyridinium chloride against SARS-CoV-2. J Oral Maxillofac Surg Med Pathol. 2022. doi:10.1016/j.ajoms.2022.04.001.
22.Buonavoglia A, Lanave G, Marchi S, Lorusso P, Montomoli E, Martella V, Camero M, Prati C, Trombetta CM. In vitro virucidal activity of mouthwashes on SARS-CoV-2. Oral Dis. 2022;10:10.1111. doi: 10.1111/odi.14205.
23.Seneviratne CJ, Balan P, Ki Karrie Ko K, Udawatte NS, Lai D, et al. Efficacy of commercial mouth‑rinses on SARS‑CoV‑2 viral load in saliva: randomized control trial in Singapore. Infection. 2021;49:305-311. doi:10.1007/s15010-020-01563-9 .
24.Eduardo FP, Corrêa L, Heller D, Daep CA, Benitez C, et al. Salivary SARS-CoV-2 load reduction with mouthwash use: a randomized pilot clinical trial. doi:10.1016/j.heliyon.2021.e07346
25.Ferrer MD, Barrueco ÁS, Martinez-Beneyto Y, Mateos-Moreno MV, Ausina-Márquez V, García-Vázquez E, et al. Clinical evaluation of antiseptic mouth rinses to reduce salivary load of SARS-CoV-2. Sci Rep. 2021;11(1):24392. doi:10.1038/s41598-021-03461-y.
Editado por: © SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria.
© Copyright SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria. Este artículo está disponible en la url https://www.farmaceuticoscomunitarios.org/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES


