- La revista
- Nike air jordan max 13 hologram Bred Black Red 2019 Release Date , air jordan max 1 rebel chicago white varsity red black , IetpShops
- nike air jordan 1 mid outlet
- nike sb varsity red dunks black and blue white
- adidas Basic Insulated Μπουφάν
- Adidas forum low ✨⭐🌟 кроссовки для города форум как форсы но от адидас, nmd r1 vs nmd r2 womans sizing pants suit , Украина #123590352, а не найк. форум — цена 2049 грн в каталоге Кроссовки ✓ Купить мужские вещи по доступной цене на Шафе
- air jordan 4 white tech grey black fire red ct8527 100 release date
- a ma maniere air jordan 1 high do7097 100 release date
- Air Jordan 4 White Tech CT8527 100 Release Date
- nike dunk low university blue
- buy air jordan 1 twist panda cd0461 007 store list
- Presentación
- Políticas y proceso editorial
- Rigor científico y metodológico
- Producción y Administración
- Comités
- Normas presentación
- Consideraciones eticas
- Enviar artículo
- Hemeroteca
- Indexación
- Buscar
- Contacto
Farm Comunitarios. 2023 Jan 02;15(1):22-40. doi: 10.33620/FC.2173-9218.(2023).04
Farmacovigilancia de las vacunas frente a COVID-19 en farmacias comunitarias. Resultados tras la primera dosis
INTRODUCCIÓN
La actual pandemia denominada enfermedad infecciosa por coronavirus-2019 (COVID-19), originada por el coronavirus-2 causante del síndrome respiratorio agudo severo (SARS-CoV-2) ha provocado desde sus inicios 596.211.108 casos confirmados y 6.453.854 fallecidos a fecha de 22 de agosto de 2022 en más de 190 países (1). En España el número de casos confirmados en el informe de 19 de agosto de 2022 es de 13.314.764 y el de fallecidos de 112.128 según el Ministerio de Sanidad (2).
Después de tres oleadas epidémicas sucesivas en menos de un año, sin que las medidas de contención hubieran resultado efectivas y la capacidad del sistema sanitario nacional se viese desbordada e incapaz de reaccionar en la proporción adecuada, la disponibilidad de las vacunas apropiadas se convirtió para la población en la única posibilidad de conseguir la vuelta a una normalidad próxima a la anterior.
El Comité de Medicamentos de uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) recomendó en diciembre de 2020 la autorización provisional de Comirnaty® (CO), vacuna frente a la COVID-19 desarrollada por BioNTech y Pfizer, tras una evaluación favorable de su balance beneficio/riesgo (3). En las semanas siguientes lograron el mismo resultado tras su evaluación por el CHMP la vacuna del laboratorio Moderna, Spykevax® (SP), Vaxzevria® (VZ) de Oxford-Astra-Zeneca, y algo más tarde la COVID-19 Vaccine Janssen® (JA) (actualmente denominada Jcovden®), con lo que a comienzos de 2020 ya se estaban administrando a la población española cuatro vacunas frente a la COVID-19 (4).
La experiencia acumulada en el desarrollo de vacunas y los esfuerzos económicos y científicos de estados, investigadores e industria farmacéutica hicieron posible disponer en tiempo récord de vacunas que en los ensayos en fase II y III, bajo condiciones de ensayos clínicos con muestras más amplias de lo habitual, han demostrado su eficacia y seguridad (5).
No obstante, a la vista de la amplia extensión de su administración a la población general y el corto plazo de estudio previo a su comercialización, es necesario implementar procedimientos que permitan un estrecho seguimiento de su seguridad, tanto de acontecimientos adversos infrecuentes, no detectados en los ensayos previos, como los que puedan aparecer a medio o largo plazo que permitan completar su perfil de eficacia y seguridad (6), ya que se estima que durante las tres fases previas a la puesta en el mercado de un fármaco sólo se detectan las reacciones adversas (RA) con una incidencia superior a 1/250 personas. Se necesitan 30.000 personas en tratamiento para detectar un paciente con una reacción adversa de incidencia 1/10.000 (7).
El farmacéutico comunitario (FC) es un profesional sanitario capacitado para la identificación de potenciales nuevas reacciones adversas, y la farmacia comunitaria un espacio de salud reconocido como establecimiento sanitario privado, de interés público, que permanece durante toda la pandemia abierto y accesible a la población. Las actividades de farmacovigilancia (FV) se encuentran recogidas entre las competencias y cometidos del farmacéutico comunitario en la legislación estatal y autonómica (8-10) y existen referencias de su efectividad en la detección de RA tanto a nivel local, en medicamentos de reciente comercialización (11) o especial vigilancia (12), como nacional, mediante la creación de las redes de farmacias centinela (13-15), por lo que la actividad que se pretende realizar y documentar permite colaborar a las farmacias participantes en la estrategia de vigilancia de la seguridad de las vacunas para la COVID-19 (6,16).
En consecuencia, el Grupo Berbés de Investigación y Docencia, en colaboración con los Colegios Oficiales de Farmacéuticos de Pontevedra y Ourense puso en marcha un proyecto de farmacovigilancia con la participación de un grupo de farmacias comunitarias con el fin de registrar las posibles reacciones adversas experimentadas por las personas vacunadas. En este trabajo se presentan los resultados correspondientes a las sospechas de RA detectadas con la primera dosis de las vacunas.
OBJETIVOS
General
Colaborar en la evaluación de la seguridad de las vacunas contra la COVID-19 tras su administración a pacientes que posteriormente acuden a las farmacias comunitarias.
Específicos
- Establecer el perfil de los participantes afectados por RA potencialmente causadas por las vacunas frente al SARS-CoV-2.
- Registrar y cuantificar las posibles RA detectadas tras la administración de la primera dosis de las vacunas.
- Evaluar la necesidad de atención profesional y afectación de la vida diaria.
- Valorar la actuación del FC en la atención a las personas con RA indicando medidas farmacológicas y no farmacológicas para su alivio.
- Notificar dichas RA al Centro de Farmacovigilancia de Galicia.
MATERIAL Y MÉTODOS
Diseño
Estudio cuasiexperimental observacional prospectivo, realizado en farmacias comunitarias (FC) de las provincias de Ourense y Pontevedra, desde el momento en que comenzaron a administrarse las vacunas frente al SARS-CoV-2 a la población general, a partir de febrero hasta diciembre de 2021.
Sujetos
Se incorporaron al estudio todos los usuarios de la farmacia que respondían positivamente al ser preguntados si recibieron la vacuna de la COVID-19, mayores de edad, con capacidad para entender el cuestionario y que firmaron el consentimiento para participar en el estudio.
Variables
Variable principal
Número y porcentaje de sujetos que presentan al menos una RA en relación al número de pacientes incorporados al estudio.
Otras variables
Características demográficas del participante, edad, sexo, vive solo o acompañado, lugar de trabajo, pasó la enfermedad (Sí/No), pruebas realizadas y resultados, pertenencia a grupo de riesgo, patologías y medicación de toma habitual y actual. Número, tipo y frecuencia de las sospechas de reactividad a la vacuna y eventos adversos observados. Actuación y consecuencias ante la reacción observada. Repercusión en su vida diaria.
Tamaño muestral
No se pretendió conseguir una significación estadística de los datos sobre RA observadas, sino su detección con el fin de colaborar a establecer su perfil de seguridad en reacciones infrecuentes y a medio o largo plazo, por lo que la actividad no se detuvo al lograr el tamaño muestral necesario, sino que continuó en el tiempo incorporada a la actuación rutinaria en la dispensación por los farmacéuticos comunitarios participantes.
No obstante, para poder valorar la significación de los resultados y tener una aproximación sobre las dimensiones mínimas del estudio, se calculó que para conseguir una precisión del 5,0 % en la estimación de una proporción mediante un intervalo de confianza asintótico Normal al 95 % bilateral, asumiendo una proporción (porcentaje de sujetos que presenten al menos una RA) del 20,0 %, será necesario incluir 246 participantes en el estudio. Previendo la posibilidad de un 20 % de pérdidas, cuestionarios defectuosos o incompletos, se prevé incorporar al estudio un mínimo de 307 individuos.
Procedimiento
Tras la oferta de participación en el estudio, se realizaba la entrevista en la zona de atención personalizada. Las contestaciones del participante se recogían en un cuaderno de registro cumplimentado por el farmacéutico junto con el paciente (anexo 1). La relación de posibles reacciones a la vacuna se basó en las declaradas por los laboratorios fabricantes en los artículos donde daban cuenta de los resultados de los ensayos de eficacia y seguridad realizados (17-19) y en las que figuran en sus fichas técnicas (20-23). Se excluyeron los registros en los que no se pudo completar todos los apartados.
Se realizó un seguimiento decenal presencial o telefónico 10 días después de la primera y segunda dosis de vacuna recibidas y mensual a partir del primer mes después de la segunda dosis.
Intervención educativa
Como complemento de la entrevista, y en función de los resultados, se realizaba una intervención educativa. A las personas no vacunadas se les informaba sobre la importancia de la vacunación con el fin de frenar las graves consecuencias de la enfermedad de la COVID-19 tanto a nivel individual como social, sus riesgos y beneficios reales a la vista de la evidencia científica. A los ya vacunados se les impartía educación en el reconocimiento y actuación ante sospechas de RA, se les informaba sobre las posibles reacciones adversas que podrían presentarse y la importancia de vigilar su aparición con el fin de comunicarlas y adoptar las medidas adecuadas para su control. Además de las acciones verbales se les entregaba material infográfico disponible en las webs del Ministerio de Sanidad y del Consejo General de Colegios Oficiales de Farmacéuticos con la misma orientación, que reforzaban la información verbal dada.
A los pacientes vacunados con una reacción considerada leve tras su evaluación, se les recomendaban las medidas no farmacológicas convenientes y, si era necesario, se les indicaba un medicamento sin receta adecuado para la resolución o alivio del problema de salud originado por la reacción (figura 1).
Figura 1. Resumen del procedimiento
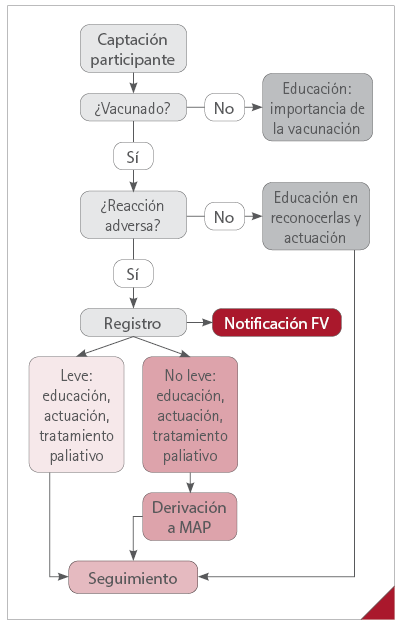
Seguimiento de los vacunados
Como se indica en el procedimiento, todos los pacientes vacunados fueron objeto de un seguimiento activo telefónico o presencial (según preferencia del paciente) por parte del farmacéutico colaborador (figura 2).
Figura 2. Resumen del seguimiento

Pacientes captados tras la 1ª dosis
En el caso de los pacientes que solo recibieron la primera dosis o los que reciben una vacuna de dosis única se hizo una primera entrevista telefónica/presencial de seguimiento 10 días después de la vacunación siempre que coincidía antes de la administración de la segunda dosis de vacuna. En el caso de la vacuna de Astra-Zeneca se hicieron además las entrevistas mensuales correspondientes hasta la aplicación de la segunda dosis. Después se hizo visita mensual hasta el 6º mes.
Pacientes captados después de que recibieron la 2ª dosis y pacientes en seguimiento desde la 1ª dosis
1ª entrevista presencial o telefónica a los 10 días de la administración de la 2ª dosis. En la entrevista se completaban los datos correspondientes a la primera dosis. A continuación, una al mes hasta el 6º mes. En el caso de que se considerase conveniente, el FC prolongaba el seguimiento durante el tiempo necesario para comprobar la evolución, la posible aparición de nuevas sospechas de RA y, en su caso, los resultados de la eventual derivación al médico.
Formación de los farmacéuticos comunitarios colaboradores
Los FC que participaron en la actividad recibieron formación por parte del grupo investigador en colaboración con los dos colegios provinciales a través de sus plataformas de formación en línea, de carácter general sobre farmacovigilancia, notificación de RA y la enfermedad COVID-19, y específica sobre la metodología del proyecto, las vacunas objeto de este trabajo, sus características, acción, reacciones encontradas en los ensayos clínicos y fichas técnicas, procedimiento a seguir ante la aparición de posibles reacciones, su evaluación y las actuaciones correspondientes.
Presentación de los resultados y análisis estadístico
Para el análisis de los datos se utilizó el programa estadístico SPSS® 22.0 para Windows®. Los datos cualitativos se expresan como porcentajes y los cuantitativos como media y desviación estándar (DE). Se utilizaron los test de chi-cuadrado para el análisis de variables cualitativas, t de Student para variables cuantitativas con distribución normal y Mann-Whitney para variables cuantitativas con distribución no normal. Para el análisis de los datos pareados se usó el test de Wilcoxon. Para relacionar las variables cuantitativas se manejaron técnicas analíticas de correlación de Pearson o Spearman. La significación estadística se fija en p<0,05.
Consideraciones éticas
El estudio se desarrolló de acuerdo con las normas de Buena Práctica Clínica de la Conferencia Internacional sobre Armonización (ICH E6) para un estudio de estas características. Se respetó en todos los casos la autonomía de los participantes, siguiendo los principios éticos de la Declaración de Helsinki vigente.
En el momento de la propuesta de incorporación al estudio, al participante se le entregaba una hoja informativa y se le solicitaba su firma en la hoja de consentimiento.
Las hojas de registro permanecieron custodiadas en las farmacias colaboradoras cumpliendo con las medidas de seguridad de nivel alto a tal efecto, como lo establece la Ley Orgánica 3/2018, de 5 de diciembre, de protección de datos personales y garantía de los derechos digitales. Los datos registrados se sometieron a un proceso de codificación y disociación (pseudonimización), y se volcaron en una hoja de Excel® previamente a su comunicación al equipo investigador, de tal forma que este nunca tuvo conocimiento de datos identificativos o identificables de los participantes.
El estudio recibió un informe favorable del Comité Ético de Investigación con Medicamentos de Galicia (CEIm-G) (Exp. 2021-007) (anexo 2).
RESULTADOS
Datos demográficos
Colaboraron 10 farmacias de la provincia de Pontevedra y 2 de Ourense, que propusieron la participación a 827 usuarios, de los que aceptaron 784 (94,8 %), rechazándose 3 al no haberse registrado los datos correctamente, por lo que el número de registros válidos fue de 781 (99,6 %), de los cuales 488 (62,5 %) correspondieron a mujeres y 293 (37,5 %) a hombres. La media de edad fue de 56,8 (DE=17,9) años. 8 (1,6 %) mujeres estaban embarazadas.
Enfermedades que refirieron: 230 hipertensión arterial, 177 dislipemias, 159 trastornos neuro-psiquiátricos, 105 cardiológicas, 92 diabetes, 68 respiratorias, 50 tiroides, 35 obesidad, 23 inmunodepresión, 17 renales, 9 oncológicas, 8 hepáticas, 6 metabólicas. Enfermos pluripatológicos: 2 (0,3 %) con 8 patologías, 2 (0,3 %) con 7, 11 (1,4 %) con 6, 22 (2,8 %) con 5, 77 (9,9 %) con 4, 94 (12,0 %) con 3 y 112 (14,3 %) con 2. Con 1 patología 216 (27,7 %) y 245 (31,4 %) manifestaban no sufrir ninguna patología previa. 25 (3,2 %) padecían alguna patología aguda en el momento de recibir la vacuna, las más frecuentes fueron: resfriado/catarro (4), vértigos (4), infección urinaria (2), anemia (2) y herpes labial (2). Casi la mitad de los encuestados tenía 60 o más años y pertenecía a algún grupo de riesgo. Únicamente 64 refirieron haber pasado la COVID-19.
Las características demográficas se muestran en la tabla 1.
Tabla 1. Características demográficas por sexo
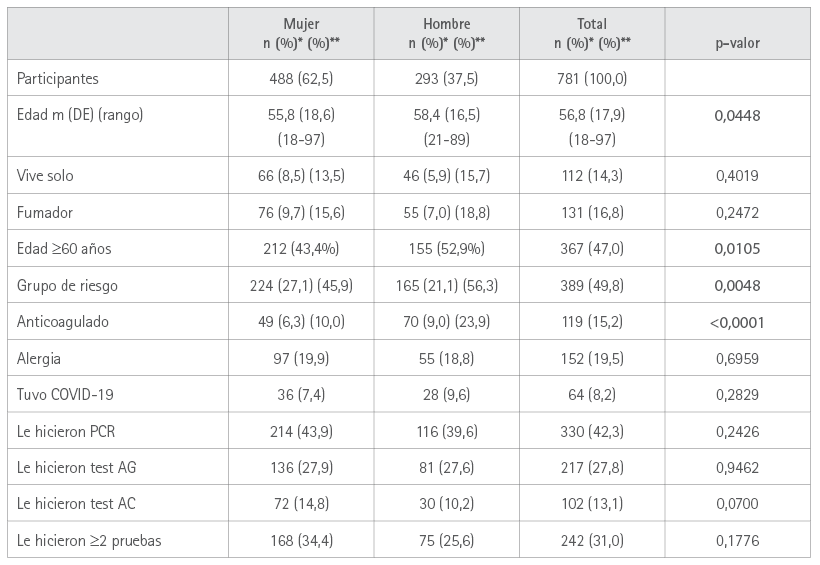
* Los porcentajes se refieren al total de vacunados (*) y al total del sexo (**)
PCR: reacción en cadena de la polimerasa; test AG: test de antígenos; test AC: test de anticuerpos.
Vacunas
La administración de las vacunas se realizó en los espacios de vacunación masiva (“vacunódromos”) a 491 (62,9 %), en un hospital 175 (22,4 %), centro de atención primaria 108 (13,8 %) y en residencia geriátrica 7 (0,9 %).
445 (57,0 %) participantes fueron vacunados en primera dosis con Comirnaty®, 282 (57,8 %) mujeres y 163 (55,6 %) hombres; 190 (24,3 %) recibieron Vaxzevria®, 118 (24,2 %) mujeres y 72 (24,6 %) hombres; 104 (13,3 %) Spikevax®,
67 (13,7 %) mujeres y 37 (12,6 %) hombres y 42 (5,4 %) Janssen®, 21 (4,3 %) mujeres y 21 (7,2 %) hombres.
204 (26,1 %) encuestados utilizaron medicamentos como profilaxis de los posibles RA de la vacuna. De ellos 165 (80,1 %) tomaron paracetamol.
Sospechas de reacciones adversas
495 (63,4 %) vacunados, 321 mujeres (65,8 %) y 174 (59,4 %) hombres sufrieron al menos una reacción adversa, p=0,0753. En la tabla 2 se muestra la distribución de las personas que sufrieron RA con las cuatro vacunas en función del sexo.
Tabla 2. Distribución por sexo y marca de vacuna de los participantes con RA
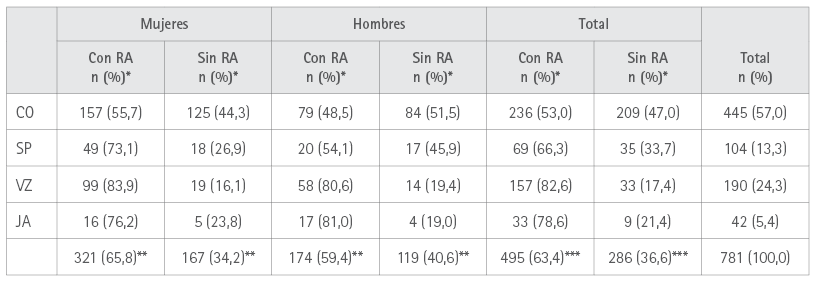
*** Sobre el total del sexo vacunados con cada vacuna.
*** Sobre el total del sexo.
*** Sobre el total de vacunados.
El número medio de RA manifestadas por los vacunados fue de 1,8 (DE=2,2) (1-13), 2,0 (DE=2,4) (1-13) en las mujeres y 1,4 (DE=1,7) (1-8) en los hombres, p<0,0001. Los porcentajes de vacunados en relación con el número de RA referidas por cada uno se muestra en la figura 3, sin diferencia significativa entre sexos (p=0,3164). El máximo fue de 13 RA, en una mujer.
Figura 3. Porcentaje de vacunados y número de RA manifestadas
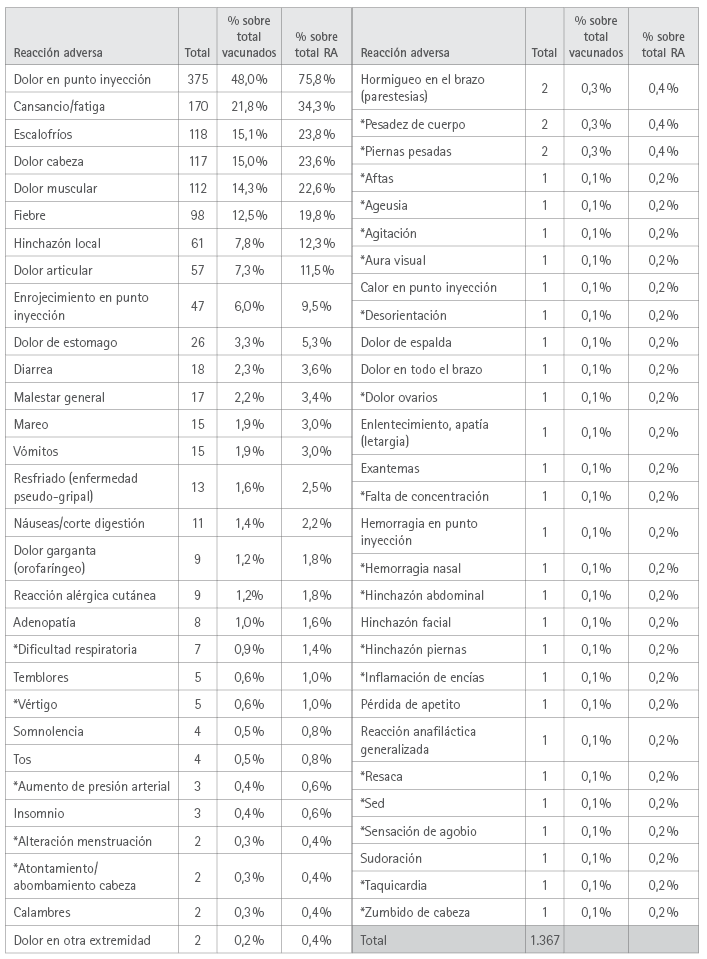
El número total de RA manifestadas por los encuestados fue de 1.367, resultando las más prevalentes, que afectaron a más del 10 % de los vacunados: dolor en el punto de inyección, referido por 375 (48,0 %), cansancio/fatiga, por 170 (21,8 %), escalofríos 118 (15,1 %), cefalea 117 (15,0 %), dolor muscular 112 (14,3 %) y fiebre 98 (12,5 %).
La relación completa de sospechas de efectos adversos manifestados con la 1ª dosis se presenta en la tabla 3.
Tabla 3. Sospechas de RA a la 1ª dosis manifestadas por los participantes

* RA no recogida en las fichas técnicas de las cuatro vacunas.
En la tabla 4 se muestran los porcentajes de vacunados de cada sexo que refirieron las RA más prevalentes.
Tabla 4. Número de RA y tipo de vacuna por sexos
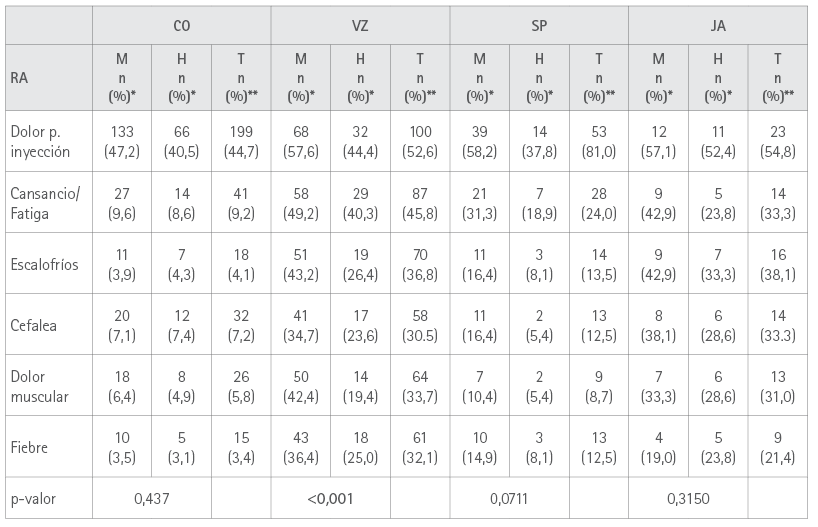
** Sobre el total del sexo vacunados con cada vacuna.
** Sobre el total de vacunados con cada vacuna
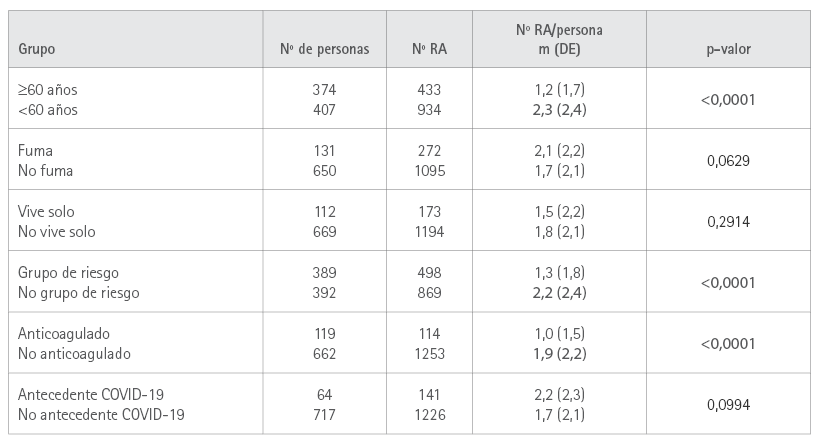
El análisis de las relaciones entre las características demográficas de la muestra y el número de RA manifestadas por participante se muestra en la tabla 5.
Tabla 5. Relación entre el número de RA y las variables demográficas
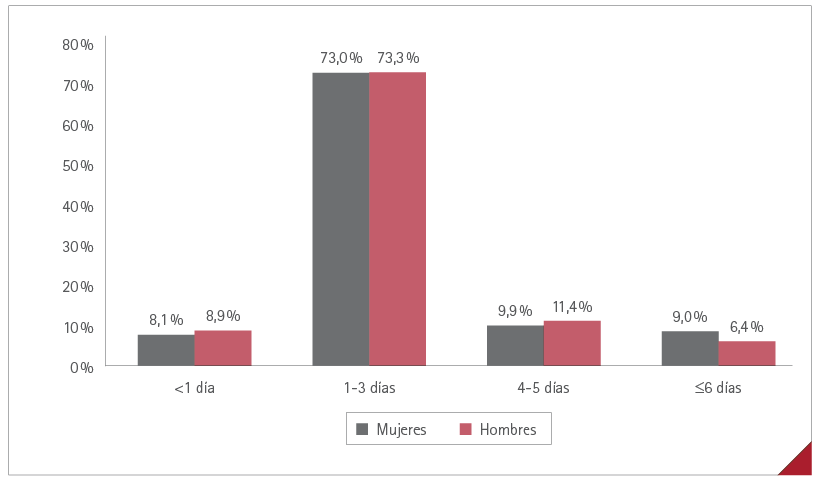
La duración media de las RA (tiempo desde su aparición hasta su resolución) fue de menos de 1 día en 114 (8,3 %) casos, de 1 a 3 días en 999 (73,1 %), de 4 a 5 días en 141 (10,3 %) y de 6 días o más en 113 (8,3 %). Sin diferencia significativa entre mujeres y hombres, p=0,4501. La duración de las RA por sexos se muestra en la figura 4.
Figura 4. Duración de las RA por sexos
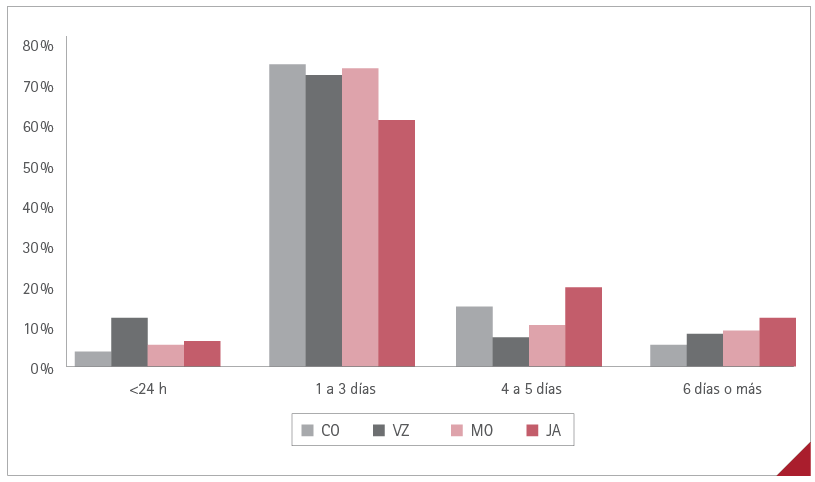
La duración de las RA para cada una de las cuatro vacunas administradas se muestra en la figura 5.
Figura 5. Duración de las RA con las cuatro vacunas
Repercusión sobre la salud y la vida diaria
En 472 (95,4 %) casos el problema de salud originado por las RA se resolvió satisfactoriamente, no obstante, a 118 (15,1 %) vacunados, 76 (23,7 %) mujeres y 42 (24,1 %) hombres (p=0,9087), la reactividad les impidió desarrollar su actividad diaria habitual. Al cabo de 6 meses, se había resuelto el 100 %.
De los 495 encuestados que manifestaron reactividad a la vacuna necesitaron ayuda profesional 77 (15,6 %), de los cuales 48 eran el 15,0 % de las mujeres y 29 el 16,6 % de los hombres (p=0,6212): acudieron a su médico de atención primaria (MAP) en el centro de salud en 30 (39,0 %) casos, (20 mujeres y 10 hombres), 9 (11,7 %) (7 mujeres y 2 hombres) al servicio de urgencias, además de 1 por derivación del MAP y otro del FC, 1 (1,3 %) hombre en hospital y 37 (48,1 %) (21 mujeres y 16 hombres) solicitaron ayuda en la farmacia.
Los farmacéuticos colaboradores comunicaron al Centro Autonómico de Farmacovigilancia las RA de 264 (53,3 %) vacunados.
DISCUSIÓN
Entre las funciones que realiza el farmacéutico comunitario se encuentra el control del uso individualizado de los medicamentos con el fin de detectar las reacciones adversas que puedan producirse en la población usuaria y notificarlas a los organismos responsables de la farmacovigilancia (8-10). Siguiendo esta premisa, y siendo el objetivo principal de este trabajo la detección, notificación y seguimiento de las reacciones adversas en usuarios de las farmacias comunitarias, cabe destacar que los resultados obtenidos muestran que, en su administración a la población general, la primera dosis de las vacunas contra el COVID-19 causó un número importante de sospechas de RA, si bien de carácter leve a moderado.
Limitaciones del estudio
Queremos señalar como posible limitación del estudio el hecho de que la manifestación de las sospechas de RA por los participantes tiene un cierto componente de subjetividad. En algunos casos, podrían atribuirse a patologías o tratamientos que ya recibiesen los pacientes, verse influenciadas por sus condiciones anímicas, haber padecido la enfermedad él, algún familiar o conocido cercano. Todo ello puede predisponerle a reconocer como sospechas de RA algunas que realmente no lo sean. Por otro lado, las reacciones adversas registradas en la farmacia suelen ser de intensidad leve-moderada, siendo las de mayor gravedad recogidas y registradas en el hospital o en los servicios de urgencias, como son los casos de síndrome de trombocitopenia, Guillain Barré o miocarditis. Muchas de estas RA leves no suelen llegar a dichos ámbitos o no se alcanzan a registrar en ellos, por lo que es posible que los datos difieran en los estudios realizados en ellos.
Además, las propias vacunas contra la COVID-19 podrían causar el efecto nocebo y alterar su resultado de seguridad. La publicidad, en ocasiones negativa, que acompañó a la autorización de emergencia junto con el desconocimiento de las reacciones adversas y la anticipación o el temor a sufrirlas puede haber aumentado la atribución errónea de síntomas previos o posteriores no relacionados realmente con la vacuna (24).
Otras limitaciones fueron la falta de acceso a la historia clínica del encuestado para confirmar la o las sospechas de RA, caracterizar su pertenencia a algún grupo de riesgo y confirmar que fue diagnosticado de COVID previamente. Los datos dependen de lo manifestado por los sujetos y de los medicamentos que dicen tomar o se figuran en las historias farmacoterapéuticas conservadas en las farmacias.
Descripción de la muestra
Participaron 781 usuarios de 57 años de edad media, de los que el 62,5 % eran mujeres. Son estas las que mayoritariamente viven solas (8,5 % vs. 5,9 % del total de la muestra), dato que coincide con lo publicado por el Instituto Nacional de Estadística para Galicia (25), debido sin duda a la mayor esperanza de vida de las mujeres con respecto a los hombres (26). No obstante, dentro de cada sexo, en nuestra muestra, es mayor el porcentaje entre los hombres (15,7 % vs. 13,5 %).
En cuanto al consumo de tabaco, nuestra muestra presenta un mayor porcentaje de fumadores masculinos, lo que se corresponde también con la estadística nacional (27).
El número de encuestados pertenecientes a grupos de riesgo (28,29) y de anticoagulados es también mayor entre los hombres, coincidiendo en este último caso con algunos estudios, pero no con otros, pues los estudios difieren notablemente en las relaciones de anticoagulación y sexo (30).
En consecuencia, consideramos la muestra suficiente, tal como resulta del cálculo realizado, para la representatividad del estudio. Por otro lado, su composición se adecúa a la población que acude a las farmacias, mayoritariamente femenina, obtenida en otros estudios (31-33).
Solo el 8,2 % de los vacunados decía haber pasado la COVID-19 (36 mujeres y 28 hombres) previamente a recibir la vacuna, dato que difiere con lo publicado por Álvarez et al. (34) en la que el 50 % de su población de estudio había pasado la enfermedad, lo que puede explicarse por el distinto ámbito en que se hizo este estudio.
A pesar de que no se recomendaba la profilaxis general con analgésicos o antiinflamatorios, ya que no se tenían datos claros sobre el impacto de estos sobre la respuesta inmune (16,35), encontramos que una cuarta parte de los pacientes entrevistados usaron algún medicamento con esa finalidad, siendo paracetamol el más utilizado (80,1 %), debido seguramente al desconocimiento por parte de la población de las posibles reacciones adversas de la vacuna y su temor a estas.
La pandemia por COVID-19 ha generado importantes retos sobre el sistema sanitario español, que necesitó reorganizar sus servicios, con transferencia de personal a las áreas de mayor necesidad. Fue una solución viable, para responder de forma adecuada al problema acuciante de la limitación de recursos humanos, para realizar una vacunación masiva y eficiente a toda la población. De esta manera nos hemos encontrado en nuestro estudio 4 lugares diferentes: “vacunódromos” (62,9 %), hospitales (22,4 %), atención primaria (13,8 %) y residencias geriátricas (0,9 %). La complejidad para realizar una vacunación efectiva y la necesidad de dotar a la atención primaria adecuadamente para que cumpla con los requisitos establecidos hizo que no fuera la mayoritaria en el proceso de vacunación. Quedó claro, por tanto, el éxito de los “vacunódromos” y áreas descentralizadas frente a los hospitales, reservados estos para el tratamiento de los casos más graves. El estudio de cómo implementar este modelo de zonas más descentralizadas y accesibles, entre las cuales podrían estar las farmacias, tal como sucede en muchos países de nuestro entorno, para tratar o prevenir ciertos problemas sanitarios y descongestionar a los servicios de salud sería adecuado (36).
Los encuestados de nuestro estudio recibieron cuatro tipos distintos de vacunas: Cominarty® y Spykevax®, vacunas de RNA mensajero, Vaxzervia® y Janssen® ambas con adenovirus como vector. Las proporciones de las vacunas recibidas por los participantes en nuestro estudio no coinciden totalmente con los datos que se reflejan en los informes del Ministerio de Sanidad, pues estos contabilizan vacunas administradas hasta la actualidad, mientras que los nuestros se limitan al año 2021, Sí coincide Cominarty® como la marca más utilizada (37).
Sospechas de reacciones adversas
Más del 60 % de los participantes en el estudio manifestaron al menos una RA. Se trata de una cifra elevada, que no concuerda con las recogidas en otros informes, en los que varía desde 0,08 % en Galicia (38) al 0,18 % a nivel nacional (39), en los que se recogen datos de notificaciones al sistema nacional de farmacovigilancia, la mayor parte procedentes de consultas médicas y de enfermería, en los que probablemente solo se reflejan RA de carácter moderado a grave que llegan a ese ámbito. En un hospital terciario de Madrid (34) fue del 2,5 % con la 1ª dosis y aumentó a 4,8 % tras la 2ª, tratándose también de notificaciones, en este caso al Servicio de Prevención de Riesgos Laborales. En dos estudios realizados con profesionales sanitarios con encuestas de respuesta voluntaria, en el caso de los nefrólogos, el 75 % de los que respondieron habían experimentado RA a la vacuna (40) y entre los farmacéuticos comunitarios de Pontevedra, el 92 % (41). Aunque las cifras están sesgadas por la metodología, creemos que apuntan a una prevalencia real de RA muy superior a la recogida en las fichas técnicas y los informes oficiales, tal como sugiere Demasi (42).
El número total de sospechas de RA con la 1ª dosis de las vacunas fue de 1.367, resultando la más prevalente el dolor en el punto de inyección, que afectó al 48 % de los vacunados y supuso un 75,8 % de las RA comunicadas, lo que coincide con otros estudios publicados (17,24,40,43), seguidas de cansancio, fatiga y escalofríos, sobre todo con VZ y JA, lo que ya aparecía en el 11º Informe de FV del Ministerio de Sanidad (44), dolor de cabeza y dolor muscular que aparecen a excepción de los escalofríos, en el mismo orden en el estudio de Amanzio et al (24). En los demás, aun coincidiendo en las RA más prevalentes, el orden difiere en todos ellos (34,38-40,43).
En conjunto observamos que en nuestro estudio la vacuna más administrada fue CO (57,0 %), que es la que menos RA provocó (53,0 %). VZ fue la siguiente más administrada (24,3 %) y la que más RA provocó (82,6 %). Parece esto indicar que las vacunas de ARNm fueron las más seguras.
Se detectaron varias sospechas de RA no recogidas en las fichas técnicas de las cuatro vacunas administradas. Si bien como hemos dicho no podemos asegurar una relación causal probada con la vacuna, creemos que algunas tienen cierta relevancia, entre ellas la dificultad respiratoria y los vértigos o las alteraciones menstruales y dolor de ovarios, aunque todavía no figuran en las fichas técnicas correspondientes (20-23). Encontramos también un caso de taquicardia, con Comirnaty®, en una mujer de 72 años sin antecedentes de haber sufrido la enfermedad, con aparición a las 6 horas y duración de un día. Esta RA, no recogida tampoco en ficha técnica, fue descrita por Marco et al (45), en tres profesionales sanitarios que sí habían pasado la enfermedad, con remisión entre 18 y 36 horas.
El porcentaje de mujeres que manifestaron RA (66 %) es mayor que el de hombres (59 %), lo que coincide con lo encontrado en los informes citados (34,38,39), aunque la diferencia no es significativa. El número de reacciones adversas comunicadas por persona es de 1,8 en el total de la muestra, en este caso con diferencia significativa entre hombres (1,4) y mujeres (2,0). Al estudiar el número de reacciones adversas con respecto a las demás variables demográficas, encontramos que los menores de 60 años tienen un mayor número de RA por persona (2,3) frente a los de 60 o más años (1,2), lo que coincide lo informado en la bibliografía (39,43) y las fichas técnicas (20-23). También hay diferencia significativa entre vacunados en grupos de riesgo y anticoagulados y los no pertenecientes a estos grupos. Se trata de una relación no analizada en otros estudios, por lo que no podemos establecer comparaciones, pero que podemos interpretar como asociada a la mayor edad de los incluidos en dichos grupos.
No se observaron diferencias significativas en relación con la condición de fumadores, vivir solo ni haberse contagiado de COVID-19 antes de la vacunación. En este último caso, este hecho sí se considera predictor de la aparición de síntomas tras la vacunación en otros estudios (34,40,43,45).
Al tratarse de RA en general leves, su duración fue corta, solo en el 8 % de los casos se prolongó más de 5 días, siendo entre 1 y 3 días para el 73 % de los encuestados. Este dato coincide con otros estudios publicados que reportan una duración de los síntomas entre 1-4 días, mayor en mujeres que en hombres (43,46), lo que no sucedió en nuestro estudio, en que la duración de los síntomas fue similar en ambos sexos.
Repercusión sobre la salud y la vida diaria
Además de esta pronta recuperación, en el 95 % de los casos las reacciones se resolvieron satisfactoriamente. Solo en menos del 5 % de los casos los síntomas permanecieron más de un mes, pero al cierre de la toma de datos para el estudio se habían resuelto todas. No obstante, al 15 % de los encuestados las molestias causadas por la reactividad a las vacunas les impidieron realizar su actividad normal, bien de tipo laboral o las rutinas de la vida diaria. Este es un aspecto importante para las personas vacunadas tanto trabajadores activos como jubilados, que no ha sido considerado en los informes que hemos podido revisar, y que podría tener cierta influencia en la percepción posterior sobre la peligrosidad de las vacunas.
El 16 % de los vacunados que sufrieron RA necesitó ayuda profesional para la resolución del problema de salud originado por estas. Para ello, aproximadamente la mitad acudieron a la farmacia solicitando la atención del FC, ratificando la confianza de la población en su proximidad, accesibilidad y capacidad en momentos de saturación de los servicios sanitarios públicos. Este valoraba la gravedad o no de la RA, derivando al médico o servicio de urgencias si lo consideraba necesario o indicando un medicamento y/o medidas no farmacológicas para aliviar los síntomas. Esta labor, realizada por los FC no solo en nuestro estudio, sino de manera general en la atención a las personas vacunadas que acudían a las farmacias manifestando síntomas compatibles con reactividad a las vacunas frente a la COVID-19, supuso una importante aportación al sistema de salud al colaborar en la racionalización del uso de los recursos sanitarios públicos, con un considerable ahorro de esfuerzo y costes evitando visitas innecesarias a los centros de salud y servicios de urgencias, actuando como un eficiente primer escalón de la atención primaria.
Esperamos haber contribuido con este trabajo, que continuará con el análisis de las RA detectadas tras la 2ª dosis de las vacunas y la comparación entre ambas dosis, a un mejor conocimiento de su perfil de seguridad al haber puesto de manifiesto numerosas sospechas de RA, alguna de cierta relevancia, no recogidas en las fichas técnicas.
También, tal como ya comentamos, y con las limitaciones señaladas, creemos que los informes de las autoridades sanitarias no recogen la totalidad de las RA producidas por las vacunas contra la COVID-19 ni el número real de personas vacunadas que sufrieron RA tras la vacunación. Posiblemente se trata de un problema de infranotificación al sistema de farmacovigilancia de las RA leves, tanto por los profesionales sanitarios como por los propios vacunados, que en nuestro caso sí se han recogido. Tampoco reflejan la repercusión sobre la vida diaria, laboral y personal de los vacunados, que desde nuestro punto de vista ha sido considerable, sin que todo ello menoscabe el trascendental beneficio obtenido con su administración, tanto en pérdida de vidas como en disminución de los sufrimientos y secuelas causados por los casos graves, que se han reducido drásticamente y han permitido recuperan una relativa normalidad tras casi dos años de pandemia.
Consideramos que este tipo de trabajos servirán para reforzar la posición clave del farmacéutico comunitario en la estructuras de la atención primaria de salud y los deseables mecanismos de comunicación y colaboración con los demás profesionales sanitarios, participando desde una posición en la comunidad, próxima y accesible a sus usuarios, a pesar de la pandemia, en un momento en que los centros de salud y hospitales evitaban la atención personal a los pacientes con el fin de minimizar los riesgos para su salud.
AGRADECIMIENTOS
A los 784 vacunados que aceptaron incorporarse a nuestro proyecto y participar en el seguimiento posterior. A todos los farmacéuticos comunitarios de las farmacias que colaboraron en el estudio. Sin la disponibilidad, paciencia y dedicación de todos ellos no hubiera sido posible llevarlo a cabo.
Farmacéuticos colaboradores: Farmacia Carballido (Ourense): Rosa Mª Carballido Gago, Mª Pilar González Abades; Farmacia MT Rodríguez (Ourense): Mª Teresa Rodríguez Rodríguez, Laura León Rodríguez, Ruben Alonso Bailez, Lara Fernández Puga; Farmacia Rey Carballeda (Pontevedra): Belén Rey Carballeda, Begoña Gago Arca; Farmacia Andrés (Vigo): J. Carlos Andrés Iglesias, Rocío Mera Gallego, Alex Piñeiro Abad; Farmacia Colmenero (Vigo): Patricia López Colmenero, Miriam Barreiro Juncal, Laura Pérez Molina; Farmacia Acea (Vigo): Raquel Acea Lorenzo, Mónica González Blanco; Farmacia Mallada (Vigo): Álvaro Mallada Garabato, Diego López Cantorna; Farmacia Fornos (Cangas do Morrazo): José A. Fornos Pérez, Patricia García Rodríguez, Lorena Tenorio Salgueiro; Farmacia Cordeiro (Moaña): Marta Fernández Cordeiro; Farmacia Cebreiro (Tui): Mª José Cebreiro Mosquera, Carla Novás García; Farmacia Rodríguez, (Crecente): Ramón Rodríguez Álvarez, Bibiana Guisado Barral, Xurxo Diz Gerpe; Farmacia Alonso (O Rosal): Ricardo Alonso Pérez, Yésica Oza Araujo.
Nuestro agradecimiento también al personal del Departamento Técnico del COF de Pontevedra y a los presidentes de los COF de Pontevedra y Ourense por su apoyo y por la difusión de nuestro proyecto entre sus colegiados.
REFERENCIAS BIBLIOGRÁFICAS
1. COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU). [Consultado 22/8/2022]. Disponible en: https://www.arcgis.com/apps/dashboards/bda7594740fd40299423467b48e9ecf6
2. Ministerio de Sanidad. Actualización nº 626. Enfermedad por SARS-CoV-2 (COVID-19). 19/8/2022. [Consultado 22/8/2022]. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/Actualizacion_626_COVID-19.pdf
3. Ministerio de Sanidad. La EMA recomienda la autorización de la primera vacuna frente a la COVID-19 [Nota informativa]. 21/12/2020. [Consultado 25/7/2022]. Disponible en: https://www.aemps.gob.es/informa/notasInformativas/laAEMPS/2020/docs/NI-AEMPS-38-2020- vacuna-HMA.pdf?x54046
4. European Commission. EU Vaccines Strategy. Authorised Vaccines 2021. [Consultado 25/7/2022]. Disponible en: https://ec.europa.eu/info/live-work-travel-eu/coronavirus-response/public-health/eu-vaccines-strategy_en#authorised-vaccines
5. Ministerio de Sanidad. La AEMPS lanza una campaña sobre las garantías de las vacunas frente a la COVID-19. [Nota informativa]. 21/12/2020. [Consultado 27/7/2022]. Disponible en: https://www.aemps.gob.es/informa/notasinformativas/laaemps/2020-laaemps/la-aemps-lanza-una-campana-sobre-las-garantias-de-las-vacunas-frente-a-la-covid-19/
6. Ministerio de Sanidad. Vigilancia de la Seguridad de las vacunas frente a la COVID-19 V-6. 17/12/2020. [Consultado 27/7/2022]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/vacunas/docs/vigilancia_seguridad_vacunas_COVID-19.pdf?x54046&x95597
7. Pirmohamed M, Breckenridge AM, Kitteringham NR, Park BK. Adverse drug reactions. BMJ. 1998;316(7140):1295-8. doi:10.1136/bmj.316.7140.1295
8. Ley 33/2011 de 4 de octubre, General de Salud Pública. Boletín Oficial del Estado, Núm. 240 de 5 de octubre de 2011. Disponible en: https://www.boe.es/eli/es/l/2011/10/04/33
9. Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano. Ministerio de Sanidad, Servicios Sociales e Igualdad. BOE nº 179, de 27 de julio de 2013. Disponible en: https://www.boe.es/eli/es/rd/2013/07/26/577
10. Ley 3/2019, de 2 de julio, de ordenación farmacéutica de Galicia. Diario Oficial de Galicia, nº 130 de 10 de julio de 2019. Págs. 32380- 32447. Disponible en: https://www.boe.es/buscar/pdf/2019/BOE-A-2019-13517-consolidado.pdf
11. Lorenzo Veiga B, Marcos González L, Acuña Ferradanes A, Mera Gallego R, Vérez Cotelo N, Andrés Iglesias JC, et al. Farmacovigilancia en farmacia comunitaria de medicamentos recientemente comercializados. Pharm Care Esp. 2015;17(3):360-75. Disponible en: https://www.pharmcareesp.com/index.php/PharmaCARE/article/view/235
12. Alonso Lovera P. Farmacovigilancia de psicofármacos en una farmacia de A Coruña (España). Farmacéuticos Comunitarios. 2016;8(1):5-12. doi:10.5672/FC.2173-9218.(2016/Vol8).001.02
13. Acta Sanitaria. El COFM reconoce la labor de los integrantes de la Red de Farmacias Centinela de Madrid. Actualizado: 2018. [Consultado 23/7/2022]. Disponible en: https://www.actasanitaria.com/cofm-reconoce-integrantes-red-farmacias-centinela/
14. Acta Sanitaria. Farmacias centinela de Castilla y León detectan más de un millar de problemas con fármacos. Actualizado: 2020. [Consultado 23/7/2022]. Disponible en: https://www.actasanitaria.com/farmacias-centinela-de-castilla-y-leon-detectan-mas-de-un-millar-de-problemas-con-farmacos/
15. Acta Sanitaria. Castilla-La Mancha pone en valor el papel de la Red de Farmacias Centinela. Actualizado: 2019. [Consultado 23/7/2022]. Disponible en: https://www.actasanitaria.com/castilla-la-mancha-pone-valor-papel-la-red-farmacias-centinela/
16. Xunta de Galicia. Dirección Xeral de Saúde Pública. Plan galego de vacinación fronte ao SARS-CoV-2. V8.2 7/4/2022. [Consultado 10/8/2022]. Disponible en: https://coronavirus.sergas.gal/Contidos/Plan-galego-vacinacion-COVID
17. Polack F, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA COVID-19 Vaccine. N Engl J Med. 2020. doi:10.1056/NEJMoa2034577
18. Anderson EJ. Rouphael NG, Widge AT, Jackson LA, Roberts PC, Makhene M, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020;383:2427-38. doi:10.1056/NEJMoa2028436
19. Voysey M, Costa Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2020. Disponible en: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32661-1/fulltext
20. Agencia Europea del Medicamento. Ficha técnica Comirnaty®. [Consultado 16/8/22]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_es.pdf
21. Agencia Europea del Medicamento. Ficha técnica Spikevax®. [Consultado 24/7/22]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/spikevax-previously-covid-19-vaccine-moderna-epar-product-information_es.pdf
22. Agencia Europea del Medicamento. Ficha técnica Vaxzevria®. [Consultado 24/7/22]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product-information_es.pdf
23. Agencia Europea del Medicamento. Ficha técnica COVID-19 Vaccine Janssen®. [Consultado 24/7/22]. Disponible en: https://ec.europa.eu/health/documents/community-register/2021/20210311151284/anx_151284_es.pdf
24. Amanzio M, Mitsikostas DD, Giovannelli F, Cipriani GE, Brown WA. Adverse events of active and placebo groups in SARS-CoV-2 vaccine randomized trials: A systematic review, The Lancet Regional Health. 2022 Ene; 5(1):e2143955. doi:10.1016/j.lanepe.2021.100253
25. Instituto Nacional de Estadística. Número de hogares unipersonales por comunidades y ciudades autónomas según sexo, edad y estado civil. 2020. [Consultado 15/7/2022]. Disponible en: https://www.ine.es/jaxi/Tabla.htm?path=/t20/p274/serie/prov/p02/l0/&file=02014.px&L=0
26. Instituto Nacional de Estadística. Salud: esperanza de vida. 2022. [Consultado 15/7/2022]. Disponible en: https://www.ine.es/ss/Satellite?L=es_ES&c=INESeccion_C&cid=1259926380048&p=1254735110672&pagename=ProductosYServicios/PYSLayout
27. Instituto Nacional de Estadística. Salud: consumo de tabaco según grupo de edad y periodo. 2022. [Consultado 15/7/2022]. Disponible en: https://www.ine.es/jaxi/Datos.htm?path=/t00/mujeres_hombres/ tablas_1/l0/&file=d07001.px
28. Ministerio de Sanidad. Información Científica-Técnica. Enfermedad por coronavirus, COVID-19. Actualizado2/6/2020. [Consultado 13/6/2020]. Disponible en: https://www.mscbs.gob.es/en/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/ITCoronavirus.pdf
29. Ministerio de Sanidad. Procedimiento de actuación para los servicios de prevención de riesgos laborales frente a la exposición al SARS-CoV-2 8/6/2020. [Consultado 13/6/2020]. Disponible en: https://www.mscbs.gob.es/en/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/PrevencionRRLL_COVID-19.pdf
30. Jorge Araujo P. El perfil del paciente anticoagulado de un centro de salud de Gran Canaria. 02/04/2019. [Consultado 17/8/2022]. Disponible en: https://revistamedica.com/paciente-anticoagulado/
31. Giménez M, Giménez MP, Giménez M, Muñoz MF, García J. Perfil de pacientes y hábitos de consumo en una farmacia comunitaria, 150 años después. Farm Com. 2016 May 26;8(Supl. 1). Disponible en: https://www.farmaceuticoscomunitarios.org/es/journal-article/perfil-pacientes-habitos-consumo-una-farmacia-comunitaria-150-anos-despues
32. Zalve JL, Gómez A, Martínez R, Pardo E, Córdoba A, Garrido E. Proyecto ‘RUMBO. Estudio de la experiencia de paciente en la farmacia comunitaria española’: perfil de los pacientes que acuden a las farmacias comunitarias en España. Farm Com. 2018;10(Supl. 1):334. Disponible en: https://www.farmaceuticoscomunitarios.org/es/journal-article/proyecto-rumbo-estudio-experiencia-paciente-farmacia-comunitaria-espanola-perfil
33. Mera-Gallego R, León-Rodríguez L, Mera-Gallego I, González-Blanco M, Fernández-Cordeiro M, Piñeiro-Abad A, et al. Percepción de los usuarios de la farmacia comunitaria sobre la COVID-19 al final de la alarma y comparación con la situación al inicio. Farm Com 2021 Jan 20;13(1):7-16. doi:10.33620/FC.2173-9218.(2021/Vol13).001.03
34. Álvarez L, Castiñeiras M, González F, Gonzáles JM, Casma RM, Nuñez MC. Reacciones adversas notificadas tras la administración de vacuna frente a COVID-19 en trabajadores de un hospital terciario. Rev Asoc Esp Med Trab. 2021; 30(2): 125-261. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_abstract&pid=S1132-62552021000200217&lng=es
35. Lobos CG. Uso del paracetamol como profiláctico o postvacunación: revisión de la evidencia. [Internet] Farmacovigilancia de vacunas. 2020. [Consultado 15/8/2022]. Disponible en: https://www.ispch.cl/newsfarmacovacunas/2020/08/03%20_Vigilancia_ESAVI_1.pdf
36. Ares-Blanco S, Astier-Peña MP, Gómez-Bravo R, Fernández-García M, Bueno-Ortiz JM. Gestión de los recursos humanos y estrategias de vacunación en atención primaria en Europa en la pandemia COVID-19. Aten Primaria. 2021; 53(10):102132. doi:10.1016/j.aprim.2021.102132
37. Ministerio de Sanidad. Gestión integral de la vacunación COVID-19. 10/8/2022. [Consultado 18/8/2022]. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/Informe_GIV_comunicacion_20220812.pdf
38. Xunta de Galicia. Prevención COVID-19. Acontecimientos adversos notificados en Galicia. Boletín de Farmacovixilancia. 2022; 1. [Consultado 18/8/2022]. Disponible en: https://libraria.xunta.gal/es/boletin-de-farmacovixilancia-no-1-2022
39. Ministerio de Sanidad. 16º Informe de farmacovigilancia sobre Vacunas COVID-19. 20/7/2022. [Consultado 18/8/2022]. Disponible en: https://www.aemps.gob.es/informa/boletines-aemps/boletin-fv/ 2022-fv/16o-informe-de-farmacovigilancia-sobre-vacunascovid-19/
40. Quiroga B, Sánchez-Álvarez E, Goicoechea M, de Sequera P. COVID-19 vaccination among Spanish nephrologists: Acceptance and side effects. Journal of Healthcare Quality Research.2021; 36(6):236-369. doi:10.1016/j.jhqr.2021.05.002
41. Andrés-Rodríguez NF, Fornos-Pérez JA, Busto-Domínguez I, Mera-Gallego R, García-Rodríguez P, Carrera-Pérez-de-Juan MD, León-Rodríguez L, Mera-Gallego I, Acuña-Ferradanes A. Efectos adversos de las vacunas frente al SARS-CoV-2 en farmacéuticos comunitarios de Pontevedra. Farm Com. 2022 Jul 21;14(3):15-21. doi: 10.33620/FC.2173-9218.(2022/Vol14).003.03
42. Demasi M. Are adverse events in COVID-19 vaccine trials under-reported? 23/11/ 2021. [Consultado 19/8/2022]. Disponible en: https://maryannedemasi.com/publications/f/are-adverse-events-in-covid-19-vaccine-trials-under-reported
43. Menni C, Klaser K, May A, Polidori L, Capdevila J, Louca P, et al. Vaccine side-effects and SARS-CoV-2 infection after vaccination in users of the COVID Symptom Study app in the UK: a prospective observational study. Lancet Infect Dis. 2021 Jul; 21 (7):939-949. doi:10.1016/S1473-3099(21)00224-3
44. Ministerio de Sanidad. 11º Informe de farmacovigilancia sobre Vacunas COVID-19. 20/12/2021. [Consultado 17/8/2022]. Disponible en: https://www.aemps.gob.es/informa/11o-informe-de-farmacovigilancia-sobre-vacunas-covid-19/
45. Marco García MT, Torres Lana A, M. Anta Agudo MB, Rufino Delgado MT. Taquicardia como efecto adverso no descrito en la vacuna Comirnaty© (vacuna COVID-19 mRNA BNT162b2 de Pfizer-BioNTech): descripción de 3 casos con antecedentes de SARS-CoV-2. Enfermedades Infecc. y Microbiol. Clin. 2022;40(5):276-277. doi:10.1016/j.eimc.2021.03.008
46. Al Khames QA, Alkhaffaf WH, Hatem TH, Nassir KF, Batineh Y, Dahha, AT, et al. Safety of COVID-19 vaccines. J Med Virol. 2021;93 (12):6588-6594. doi:10.1002/jmv.27214
Editado por: © SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria.
© Copyright SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria. Este artículo está disponible en la url https://www.farmaceuticoscomunitarios.org/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES


