- La revista
- NIKE AIR JORDAN 1 GOLF LOW RUST PINK , IetpShops , Russell Westbrook Nike jordan 1 flight 4 premium кроссовки мужские Northern Lights All Star
- nike lebron x nike pink green hair women 2017 DM7597 - 100 Release Details - StclaircomoShops - scarpe nike air max silver metallic
- AR0038 - Air Jordan Super.Fly MVP PF 'White' , 100 - The outsole of the Air Jordan 5 Low Doernbecher Freestyle - JmksportShops
- adidas Samba Sizing: How Do They Fit? , adidas nebzed k eh2542 negras , IetpShops
- Taylor Swift Sang Her Whole Setlist on the Treadmill Every Day
- air force 1 shadow
- adidas Ultra Boost 2022 COLD.RDY Magic Grey GZ0128 Release Date
- air jordan 1 retro high og university blue 555088 134
- Air Jordan 4 White Tech CT8527 100 Release Date
- a ma maniere air jordan 1 high do7097 100 release date
- Presentación
- Políticas y proceso editorial
- Rigor científico y metodológico
- Producción y Administración
- Comités
- Normas presentación
- Consideraciones eticas
- Enviar artículo
- Hemeroteca
- Indexación
- Buscar
- Contacto
Farm Comunitarios. 2021 Oct 06;13(4):28-42. doi: 10.33620/FC.2173-9218.(2021/Vol13).004.05
Carga y profilaxis de la enfermedad meningocócica invasiva: actualización sobre la vacunación frente al serogrupo B
Introducción
La enfermedad meningocócica invasiva (EMI) es una infección causada predominantemente por Neisseria meningitidis (meningococo), que suele presentarse como meningitis o sepsis (1). La enfermedad se presenta con menor frecuencia como neumonía, artritis, conjuntivitis, pericarditis o miocarditis (2). La EMI es temida en el mundo por su rápida evolución y su elevada letalidad: la muerte puede ocurrir en 24-48 horas desde el comienzo de los síntomas (3). Algunos supervivientes sufren secuelas devastadoras (3,4). Como sucede con otras enfermedades infecciosas, desde hace 40 años existen vacunas de polisacáridos y conjugadas (5) específicas para patógenos (serogrupos) concretos (3). Hace poco se han desarrollado dos vacunas de proteínas frente al meningococo grupo B (MenB), una de 4 componentes (4CMenB, Bexsero, GSK) y otra de 2 componentes (MenB-FHbp, Trumenba, Pfizer) y ambas han sido utilizadas frente a brotes (6-8). Además, 4CMenB se ha introducido en varios programas nacionales de inmunización (PNIs) del mundo (9,10), así como en programas regionales de inmunización, como es el caso de España donde está incluida para la vacunación de lactantes en Castilla y León y las Islas Canarias (11,12).
La vacunación frente a la EMI está incluida en el PNI español que se modificó en 2019: la dosis de la vacuna conjugada del serogrupo C (MenC) para niños de 12 años se sustituyó por la vacuna tetravalente conjugada frente a los serogrupos A, C, W e Y (vacuna MenACWY) (13), con un rescate para adolescentes de 13-18 años que abarcaría un periodo de 2-3 años (13). Las regiones de Castilla y León y Andalucía también incluyen la vacunación con MenACWY a los 12 meses en sus programas (11,14). Este último esquema está recomendado por el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP), que también recomienda incluir en el PNI, a partir de los 2 meses de edad, la vacuna frente al patógeno responsable de la mayoría de las EMI en España, MenB (15,16).
La Organización Mundial de la Salud (OMS) ha fijado 2030 como horizonte temporal para derrotar a la meningitis (3). Se establecieron tres objetivos: erradicar las epidemias de meningitis y reducir en un 80 % los casos y muertes asociadas y en un 50 % el impacto de las secuelas (3). Todas las regiones de la OMS están implementando la hoja de ruta para derrotar a la meningitis con estrategias específicas adaptadas a sus necesidades (3).
Por su parte, la pandemia de COVID-19 ha supuesto una nueva amenaza para las enfermedades prevenibles con vacunas: la interrupción de servicios esenciales ha reducido la cobertura vacunal de forma alarmante (17). Numerosos países han comunicado a la Alianza Mundial para el Fomento de la Vacunación y la Inmunización la suspensión moderada-intensa o absoluta de los servicios de inmunización durante marzo-abril de 2020. Millones de personas en el mundo corren, por tanto, riesgo de contraer enfermedades prevenibles mediante vacunación (18). Las farmacias pueden contribuir a mantener las coberturas vacunales; así lo sugiere la OMS en su directriz operativa (17). Los farmacéuticos son los profesionales que ocupan la primera línea de atención a los pacientes y cada día deben responder a preguntas sobre enfermedades y su tratamiento. Por eso, reforzar el rol de los farmacéuticos como fuente de información podría contribuir a restablecer los servicios esenciales interrumpidos por la pandemia de COVID-19.
Hemos revisado detalladamente la última evidencia científica sobre la EMI y las vacunas disponibles para su prevención, con el fin de ayudar a los farmacéuticos en su rol fundamental como asesores sanitarios. En esta revisión resumimos los conocimientos actuales sobre la patogenia, manifestaciones clínicas y complicaciones de la EMI; también exponemos las características de las vacunas, en particular las vacunas frente a la EMI por MenB. La figura 1 resume el contexto, los resultados y el impacto de esta revisión para los profesionales sanitarios.

Figura 1 Resumen en lenguaje sencillo
Epidemiología
Según las últimas estimaciones, en 2018 3.233 personas sufrieron EMI en 30 países de la Unión Europea/Espacio Económico Europeo (figura 2) (19), 392 de ellas en España. La EMI es endémica (con casos esporádicos), pero también epidémica (con brotes) (20). La incidencia de EMI en Europa varía mucho de un país a otro. Por ejemplo, en 2018 la tasa de notificación varió de 0,00/100.000 habitantes en Islandia a 1,82/100.000 en Irlanda, con una media europea de 0,62/100.000 y una incidencia de 0,84/100.000 en España (19). De 2000 a 2012 la tasa de notificación española sobrepasó la media europea, pero luego disminuyó hasta situarse por debajo a partir de 2013. Sin embargo, en los últimos años ha aumentado y alcanzado de nuevo la media europea (figura 2) (19).
La EMI afecta principalmente a lactantes (menores de 12 meses), seguidos de niños y adolescentes (3), aunque la colonización bacteriana se da más en los adultos jóvenes y es rara en los lactantes (21). En la temporada 2017-2018, en España, la tasa de notificación fue mayor en lactantes y niños de 1-4 años (8,65 y 3,19/100.000 respectivamente) (22). En esa misma temporada, la letalidad total alcanzó 12,7 % en España (346 casos de EMI y 44 muertes) (figura 2) (22).
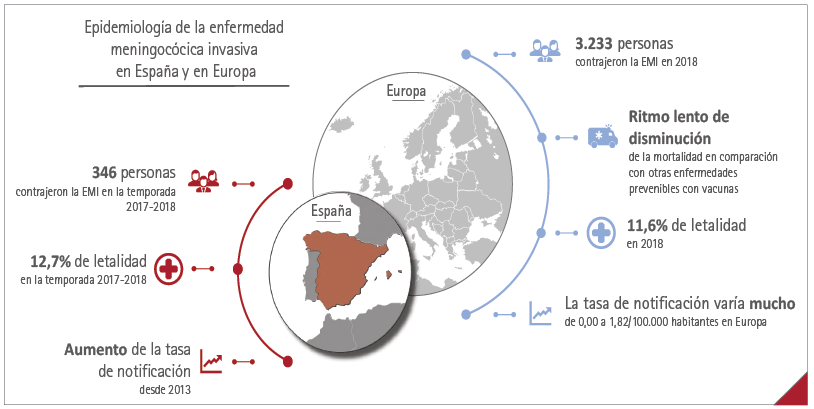
Figura 2 Epidemiología de la enfermedad meningocócica invasiva en España y en Europa
EMI: enfermedad meningocócica invasiva.
En España, el número de casos de EMI y la tasa de letalidad proceden del informe sobre EMI de la Red Nacional de Vigilancia Epidemiológica de España para la temporada 2017-2018 (22) mientras que, en Europa, los datos de 2018 provienen del Atlas de Vigilancia de las Enfermedades Infecciosas del Centro Europeo para la Prevención y el Control de las Enfermedades (se basa en los datos proporcionados por la Organización Mundial de la Salud y los Ministerios de Sanidad de los países afectados) (19). Conviene señalar que los datos de la Red Nacional de Vigilancia Epidemiológica de España reflejan las estaciones epidemiológicas (de la semana 41 de un año a la semana 40 del año siguiente), mientras que los datos del Centro Europeo para la Prevención y el Control de las Enfermedades reflejan los años naturales.
Fuente: World Health Organization (2020) (3); European Centre for Disease Prevention and Control (ECDC) (2018) (19); Ministerio de Ciencia, Innovación y universidades (2019) (22).
Serogrupos
El meningococo es un diplococo gram-negativo que está rodeado por una membrana polisacárida, también conocida como “cápsula” (1). Se han identificado doce estructuras capsulares distintas que permiten clasificar la bacteria en los subtipos (serogrupos) (1). Seis serogrupos —A, B, C, W, X e Y— son los más habituales y peligrosos y causan una EMI potencialmente mortal (3,23).
La distribución geográfica de los serogrupos varía en el mundo (19,20,24) y cambia a lo largo del tiempo. Está influenciado por las epidemias, la emergencia de nuevos clones virulentos, las opciones de vacunación, los cambios ambientales y otros acontecimientos (25). MenB es una causa importante de EMI en Europa, Norteamérica, Norte de África y Australia; MenC, en Brasil y China; MenA, en India, y MenY, en Japón (figura 3) (20,24). Según las últimas estimaciones del Centro Europeo para la Prevención y el Control de las Enfermedades, en 2018 MenB causó la mitad de todas las EMI en Europa (47,7 %, 1.543/3.233), incluida España (39,8 %, 156/392) (19).
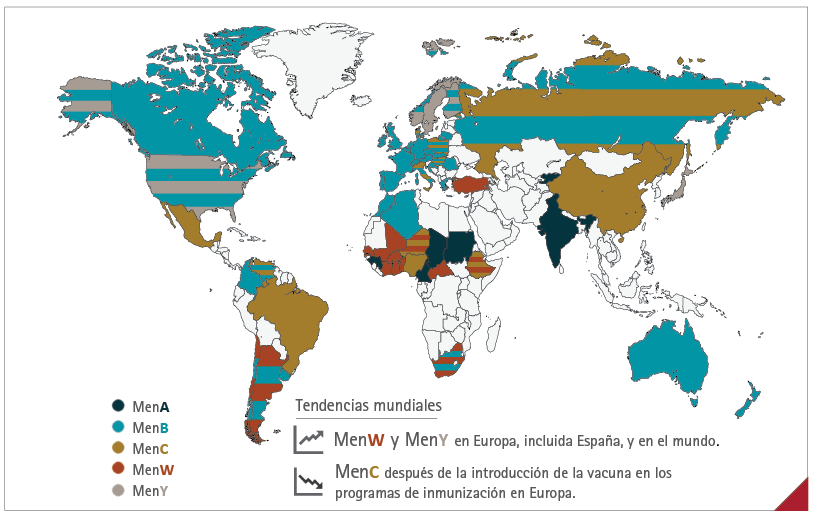
Figura 3 Epidemiología mundial de la enfermedad meningocócica invasiva por serogrupos
MenA: meningococo (serogrupo) A; MenB: meningococo (serogrupo) B; MenC: meningococo (serogrupo) C; MenW: meningococo (serogrupo) W; MenY: meningococo (serogrupo) Y.
Fuente: European Centre for Disease Prevention and Control (ECDC) (2018) (19); Acevedo R, et al (2019) (20); Ministerio de Ciencia, Innovación y Universidades (2019) (22); Peterson ME, et al (2019) (24); Whittaker R, et al (2017) (25).
Transmisión y estado de portador
Neisseria meningitidis se transmite de una persona a otra por las secreciones de nariz y boca (figura 4) (3). En los lugares concurridos, donde se produce un contacto estrecho entre la gente, se favorece la propagación bacteriana y la adquisición del estado de portador (3,20). Vivir en campus estudiantiles y cuarteles militares o participar en manifestaciones multitudinarias aumentan la probabilidad de infección y brote (20). Algunos factores adicionales de riesgo son las actividades sociales, como el tabaquismo activo o pasivo, los besos o compartir cubiertos y bebidas (figura 4) (3,20).
Neisseria meningitidis coloniza la nasofaringe de personas sanas, predominantemente adolescentes y adultos jóvenes; su frecuencia de colonización aumenta del 5 % en la lactancia al 24 % en la juventud y luego disminuye en la vida adulta (21,26). La adquisición de la bacteria produce una infección grave solo a una minoría (1,3). La nasofaringe ofrece el entorno ideal para la supervivencia bacteriana y allí suele alojarse como comensal asintomático inofensivo; el huésped entonces es “portador” (figura 4) (1,21).
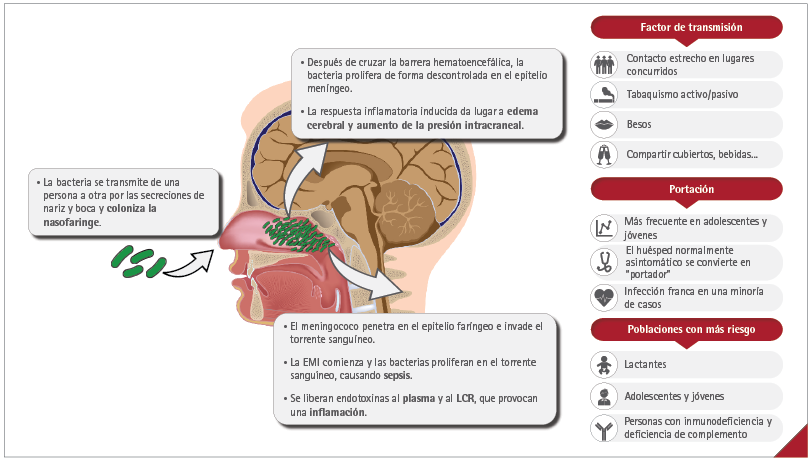
Figura 4 Transmisión, portación y patogenia de la enfermedad meningocócica invasiva
EMI: enfermedad meningocócica invasiva; LCR: liquido cefalorraquideo.
Fuente: Caugant DA, et al (2020) (1); World Health Organization (2020) (3); Acevedo R, et al (2019) (20); Read RC (2014) (21); Christensen H, et al (2010) (26); Coureuil M, et al (2017) (30); Pathan N, et al (2003) (31).
Patogenia
Aunque de manera rara, entre el primer y el decimocuarto día tras la colonización faríngea por Neisseria meningitidis, un subconjunto de “clones hiperinvasivos” (1,21,27,28) penetra en la superficie del epitelio faríngeo e “invade” el torrente sanguíneo (1). La EMI comienza a desarrollarse a partir de ese momento (1). Las poblaciones más vulnerables a la EMI son lactantes, adolescentes, adultos jóvenes y personas consideradas de riesgo de padecer la enfermedad, como, por ejemplo, personas con asplenia, inmunodeficiencia, deficiencia de complemento o tratadas con eculizumab (3,20).
El meningococo prolifera rápidamente en el torrente sanguíneo causando sepsis. También puede invadir otros órganos, ocasionando una inflamación sistémica u orgánica, o ambas (1,29,30). Los meningococos liberan endotoxinas al plasma y líquido cefalorraquídeo y el sistema inmunitario responde produciendo más citoquinas (31). La meningitis aparece cuando la bacteria atraviesa la barrera hematoencefálica y alcanza las meninges (30). La proliferación meningocócica descontrolada en el epitelio meníngeo induce un proceso inflamatorio que ocasiona edema cerebral y eleva la presión intracraneal (figura 4) (31).
Síntomas, complicaciones y secuelas
La EMI se suele manifestar con dolor de cabeza, fiebre, vómitos, rigidez de cuello, erupción cutánea, fotosensibilidad, irritabilidad, agitación y letargo (2-5, 32,33). En el Hospital Universitario de Bellvitge de Barcelona, más del 80 % de los pacientes ingresados con EMI entre 1977 y 2013 presentaron dolor de cabeza, rigidez de cuello, náuseas o vómitos y lesiones cutáneas (figura 5) (4).
Los síntomas aparecen a los 4 días de media después de la infección; el período de incubación oscila entre 2 y 10 días (3). Al principio, los síntomas pueden ser leves; luego, se agravan enseguida y pueden resultar en insuficiencia orgánica y muerte (2). La gravedad depende de la respuesta inmunitaria (2). No todos los síntomas se observan en todos los pacientes y grupos etarios. Es posible que los recién nacidos no muestren síntomas clásicos, sino un llanto sin consuelo; los menores de 2 años pueden sufrir letargo, irritabilidad o ambos (2). En los adolescentes, por ejemplo, la infección por MenW cursa con síntomas gastrointestinales que progresan rápidamente (náuseas, vómitos y/o dolor abdominal, seguidos de diarrea) que a veces producen enfermedad grave e incluso muerte (34).
Según avanza la EMI, pueden aparecer complicaciones neurológicas y sistémicas o discapacidades duraderas, como problemas auditivos (4), crisis epilépticas, ictus, debilidad en extremidades y trastornos del habla (3). Algunos recién nacidos sufren ventriculitis, hidrocefalia y absceso cerebral (3). En caso de sepsis se precisa la amputación ocasional de dedos de manos y pies o de extremidades (3).
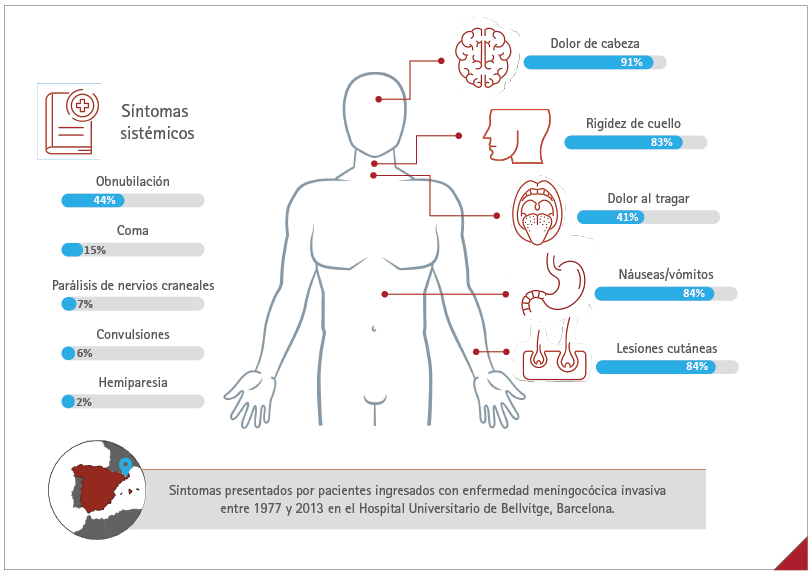
Figura 5 Síntomas observados en pacientes ingresados con enfermedad meningocócica invasiva entre 1977 y 2013 en el Hospital Universitario de Bellvitge, Barcelona
Fuente: Cabellos C, et al (2019) (4).
Tratamiento de los casos sospechosos
Toda sospecha de EMI constituye una urgencia y requiere ingreso hospitalario (35). Según estadísticas de la OMS, el 50 % de los infectados fallece si no recibe tratamiento y cuidados intensivos inmediatos (3) y más del 10 % experimenta secuelas graves (3). En general, se solicitan pruebas urgentes para confirmar la meningitis y determinar el patógeno concreto, y el tratamiento antibiótico se inicia cuanto antes (36,37) [en la primera hora desde el ingreso (35)]. Conviene recordar que los adolescentes con síntomas tardan en acudir al médico (38) y este es el grupo etario con la letalidad máxima (19). La elección empírica de los antibióticos depende de la edad y del patrón regional de sensibilidad a los antibióticos. El tratamiento se ajusta tras aislar el microorganismo causal (39). Los pacientes con síntomas graves y shock son trasladados a la unidad de cuidados intensivos donde se aplican los procedimientos apropiados (35, 40). Pese a los cuidados intensivos inmediatos y una antibioticoterapia eficaz, siguen observándose secuelas graves que dependen de la progresión del proceso inflamatorio hasta ese momento (33). Por eso, la OMS considera que la prevención es la medida más importante de lucha contra la meningitis (3).
Profilaxis y control
La profilaxis duradera puede conseguirse administrando las vacunas durante los programas de inmunización sistemática y las epidemias (3). Por eso, la OMS ha designado la vacunación como primer objetivo estratégico esencial de la hoja de ruta para combatir a la meningitis bacteriana (incluida la meningocócica) en 2030 (3). Para ganar esta batalla, uno de los primeros objetivos es facilitar el acceso a las vacunas. Otro objetivo inicial es mejorar el diagnóstico temprano de los patógenos epidémicos (3).
Sin embargo, la vacunación es la estrategia principal, no solo para prevenir los brotes, sino también para controlarlos (41). Durante los brotes hay que administrar vacunas y antibióticos para controlar la enfermedad y reducir su carga (3). La quimioprofilaxis masiva con antibióticos controla la transmisión, al reducir temporalmente la portación antes de que la vacuna ofrezca protección (42). Una vez establecida la enfermedad, esporádica o epidémica, se recomienda proteger a los contactos estrechos de los pacientes con antibióticos, como ceftriaxona, rifampicina y ciprofloxacino (39). Las personas no infectadas cercanas al paciente, como familiares, tutores, maestros y amigos, corren un riesgo de contraer meningitis meningocócica 400-800 veces mayor; la profilaxis con antibiótico reduce este alto riesgo, además de la portación bacteriana (39).
Vacunas meningocócicas
La tabla 1 resume las recomendaciones actuales en España para la inmunización sistemática frente a la EMI y las vacunas existentes.
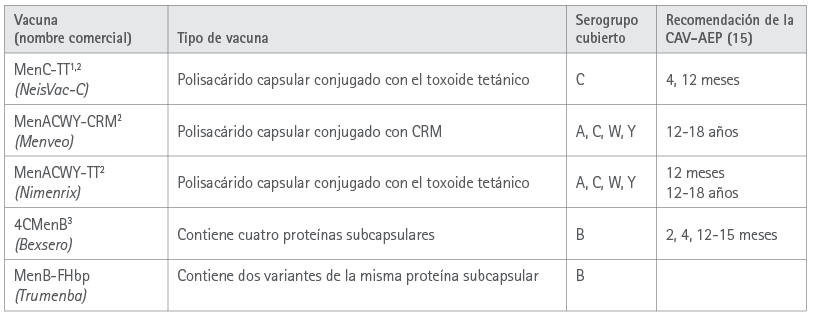
Tabla 1 Vacunas meningocócicas disponibles en España y recomendaciones respectivas para 2021 de la Asociación Española de Pediatría (CAV-AEP)
Vacunas frente a MenACWY
Han pasado 50 años desde que los bacteriólogos descubrieron que la inmunidad frente al meningococo era específica de serogrupo, plazo suficiente para desarrollar las primeras vacunas polisacáridas frente a la EMI (43,44).
La primera vacuna frente a MenC prácticamente erradicó la enfermedad por MenC en el ejército de los Estados Unidos después de su introducción en el programa de vacunación sistemática de los cuarteles estadounidenses (43). Pronto le siguió la vacuna frente a MenA y a principios de los 80 se introdujo la vacuna polisacárida tetravalente MenACWY (43). Se desarrollaron asimismo vacunas polisacáridas bivalentes (A y C) y trivalentes (A, C y W) (45). Sin embargo, las vacunas polisacáridas mostraban menos inmunogenicidad en los menores de 2 años y no inducían inmunidad duradera (43,46).
Nuevas investigaciones inspiradas en la introducción exitosa de vacunas conjugadas frente a Haemophilus influenzae tipo b revelaron que la conjugación del polisacárido capsular con una proteína portadora reforzaba la inmunogenicidad, al mejorar la memoria inmunitaria y la respuesta primaria de anticuerpos (43,46). De hecho, la introducción de la primera vacuna conjugada monovalente frente a MenC redujo drásticamente la incidencia de EMI en los niños (43). Además, esta vacuna redujo la portación de MenC, es decir, la probabilidad de transmisión a sujetos no vacunados; de esta manera, confirió protección indirecta e inmunidad colectiva (46,47). La vacuna MenC se incluyó entonces en los PNIs sistemática de muchos países (45). Las vacunas tetravalentes frente a MenACWY conjugadas con proteínas se desarrollaron después (43,45).
Vacunas frente al MenB
Las vacunas meningocócicas anteriores a las vacunas actuales frente a MenB se basaban en la cápsula polisacárida. Este método no sirvió para MenB, el patógeno predominante en cuatro continentes (Europa, Norteamérica y Sudamérica, Norte de África y Australia). El desarrollo de una vacuna frente a MenB continuó planteando retos durante decenios (20,45,48). El polisacárido del patógeno, aparte de poca inmunogenicidad, tras conjugarlo con una proteína transportadora, mostraba una posible reacción cruzada con el tejido humano (43,49). Se temía la inducción de una posible reacción autoinmune por la semejanza del polisacárido MenB con una molécula de adherencia neuronal (46,48,50,51). Por eso, se idearon métodos alternativos para este serogrupo, y la investigación se desvió de la cápsula del patógeno a las proteínas de membrana (10,46,52).
Por esta vía alternativa, a finales de la década de 1980 en Cuba y Noruega y en la de 2000 en Nueva Zelanda se crearon vacunas frente a MenB con la proteína porina A (PorA) de OMV (vesícula de la membrana externa) (53). El problema de estas vacunas era su gran especificidad para ciertas cepas; es decir, no actuaban contra cepas heterólogas del mismo serogrupo (28,50,53). Para solucionar este problema se desarrolló 4CMenB y posteriormente MenB-FHbp (10,54).
4CMenB
Los retos para el desarrollo de una vacuna frente a MenB se superaron gracias a la vacunología inversa: 4CMenB fue la primera vacuna autorizada frente a MenB. Con esta metodología los científicos lograron analizar todo el genoma del patógeno y evaluar así la capacidad de sus proteínas para inducir anticuerpos bactericidas (55). Veintiocho proteínas inducían actividad bactericida del suero frente a un gran número de cepas de MenB. Además de la PorA, las tres más inmunogénicas se seleccionaron como componentes de la vacuna (55). Los cuatro antígenos de 4CMenB son: proteína de unión al factor H (fHbp), adhesina A de Neisseria (NadA), antígeno de unión a la heparina de Neisseria (NHBA) y OMV con PorA (48) (figura 6). La inmunización con esta vacuna induce la producción de anticuerpos frente a los cuatro componentes; estos anticuerpos bactericidas se estimulan de nuevo en cuanto entran los patógenos en el torrente sanguíneo (56). Como la expresión de estos cuatro antígenos varía entre las diferentes cepas de MenB, la vacuna protege frente a múltiples cepas de MenB (57). La diana de cada componente es una vía distinta de supervivencia de MenB (8,57). Casi todas las cepas de MenB contienen genes de más de un componente de 4CMenB. Por eso, los anticuerpos inducidos por la vacuna se dirigen hacia múltiples dianas e inducen una acción bactericida, incluso si la expresión de algún antígeno es más baja (8). La evidencia revela un efecto sinérgico de los anticuerpos inducidos por los cuatro componentes, que refuerza la respuesta bactericida frente a cada antígeno (58). Cuatro antígenos conferirían una amplia cobertura de cepas y 4CMenB cubriría casi todas las cepas circulantes en Europa, como predijo un gran estudio epidemiológico europeo (59). Además, meningococos diferentes al B podrían expresar estos cuatro antígenos, lo cual indicaría una posible protección cruzada frente a otros serogrupos (60-63).
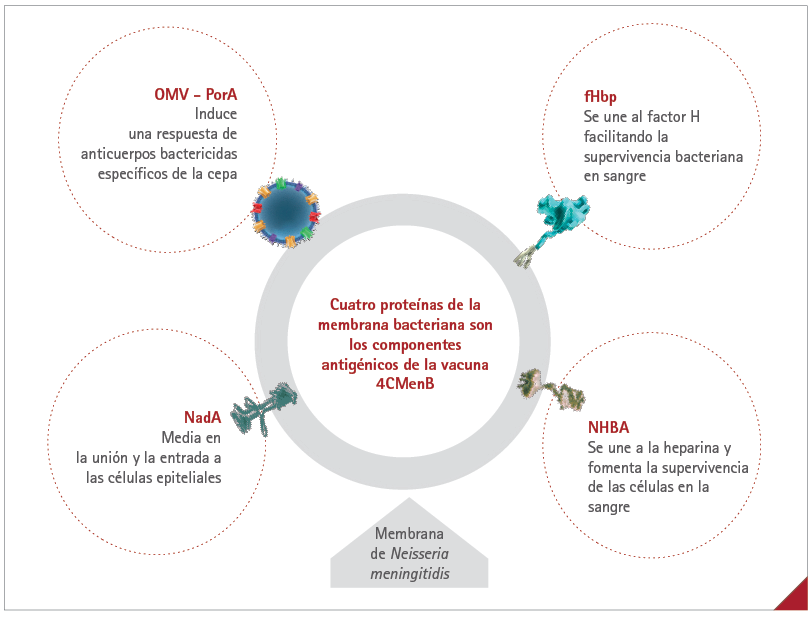
Figura 6 Los cuatro componentes antigénicos de 4CMenB
4CMenB: vacuna de 4 componentes frente al serogrupo meningocócico B; fHbp: proteína de unión al factor H; N. meningitidis: Neisseria meningitidis; NadA: adhesina A de Neisseria; NHBA: antígeno de unión a la heparina de Neisseria; OMV: vesícula de la membrana externa; PorA: proteína porina A
fHbp: esta lipoproteína se localiza en la membrana bacteriana externa de todas las cepas de N. meningitidis (57). Desde esta posición, se une a la proteína del huésped llamada “factor H”, cuya misión fundamental es inhibir uno de los mecanismos de defensa naturales del organismo. Así, la unión del factor H del huésped a la fHbp bacteriana permite la supervivencia del patógeno en el torrente sanguíneo al eludir los mecanismos defensivos del huésped (57). NadA: esta es una proteína expuesta sobre la superficie de N. meningitidis con capacidad para unirse e invadir las células epiteliales respiratorias (95). Está asimismo presente en la mitad de las cepas de la bacteria infecciosa N. meningitidis y en tres de cada cuatro linajes hipervirulentos de los serogrupos B y C (95). NHBA: esta lipoproteína expuesta sobre la superficie se une a la heparina y se ha comprobado que fomenta la supervivencia del patógeno en el torrente sanguíneo (57). Además, se ha propuesto que la NHBA facilita la invasión y colonización del endotelio tras el hallazgo de que cepas de N. meningitidis incapaces de la expresión de NHBA (knock-out) mostraban una adhesión significativamente menor a las células epiteliales (96). El gen codificador de la NHBA está presente en todos los serogrupos de N. meningitidis (96). OMV-PorA: esta es una proteína que induce la reacción inmunitaria del huésped (proteína inmunodominante) y forma parte de la OMV (48). Por eso, PorA tiene una capacidad elevada, pero específica de cepa, para inducir actividad bactericida (97).
Fuente: Bai X, et al (2011) (48).
Tras la primera autorización de comercialización en niños ≥2 meses en 2013 en Europa, 4CMenB se ha autorizado para diversos grupos etarios en más de 40 países (8,10,62,64). Las indicaciones actuales de la vacuna incluyen a todos los familiares —comenzando por lactantes de dos meses o más y siguiendo con adolescentes y adultos—, con pautas flexibles de dos o tres dosis, con o sin recuerdo (tabla 2) (56).
En 2015, el Reino Unido fue el primero que incluyó 4CMenB en el PNI sistemática de lactantes con una pauta 2+1: las dos primeras dosis a los 2 y 4 meses, respectivamente, y un recuerdo a los 12 (65-68). Esta implementación de la vacuna 4CMenB en el Reino Unido se acompañó de un impacto vacunal del 75 % (Ratio de tasas de incidencia de 0,25 [intervalo de confianza, IC, del 95 %: 0,19-0,36]) con las tres dosis (68). Varios países o regiones siguieron después al Reino Unido (9,62,69-74), y añadieron 4CMenB a su programa de inmunización para lactantes de financiación pública (Irlanda, Italia, Andorra, San Marino, Lituania, Australia del Sur [también a los 10 años], República Checa, Portugal, Malta, España [Castilla y León, Islas Canarias]), o recomendaron simplemente la vacunación (Alemania, Austria), o la utilizaron en brotes (Estados Unidos, Canadá).
Disponemos ahora de cantidad de datos sobre el uso de 4CMenB en una amplia población a nivel mundial que demuestran un excelente rendimiento de la vacuna en la vida real (8,62,75,76). Tras la introducción de 4CMenB en el PNI para lactantes de Italia, los datos de Toscana y Véneto mostraron un descenso de las tasas brutas de incidencia entre lactantes de 5,54/100.000 a 1,45/100.000 y de 4,65/100.000 a 1,96/100.000, respectivamente (75). En la población general de niños de ≤5 años, la tasa bruta de incidencia se redujo de 1,96/100.000 a 0,94/100.000 en Toscana, y de 1,94/100.000 a 1,79/100.000 en Véneto (75). La efectividad vacunal en esta población (≤5 años) fue del 93,6 % (IC del 95 %: 55,4-99,1 %) en Toscana y del 91,0 % (IC del 95 %: 59,9-97,9 %) en Véneto (75). En Portugal se llevó a cabo el primer estudio de casos y controles para evaluar la efectividad de 4CMenB, así como las consecuencias de la EMI en términos de secuelas y mortalidad, en un amplio grupo de edad (2 meses a 18 años), entre octubre de 2014 hasta marzo de 2019. La efectividad vacunal estimada fue de 79 % (razón de momios: 0.21; IC del 95 %: 0.08-0.55) y no se observaron ni secuelas ni fallecimientos en los casos que habían recibido al menos una dosis de 4CMenB (76). En Canadá, a raíz de un brote de MenB, se inició una campaña de vacunación masiva en 2014 de la población de 2 meses a 20 años de la región de Saguenay-Lac-Saint-Jean (Quebec) (6,62,77). Cuatro años después, el grupo objetivo de la campaña experimentó una llamativa reducción del 96 %, de 11,4/100.000 en 2006-2014 a 0,4/100.000 en 2014-2018 (p < 0,0001), frente al descenso del 59 %, de 1,1/100,000 en 2006-2014 a 0,5/100,000 en 2014-2018 (p = 0,1) en los mayores de 20 años (6). El impacto global estimado de la vacunación con 4CMenB fue un descenso del 86 % (IC del 95 %: -2-98 %) en el riesgo de EMI por MenB (6). Además, se registró un perfil tranquilizador de seguridad: (6,8) solo el 0,6 % de los niños de ≤2 años presentaron fiebre (temperatura ≥40 °C) en los dos primeros días (77). Tranquilizadores son a su vez los datos de seguridad de los >5 millones de inyecciones administradas a lactantes británicos desde 2015 (78). Por último, hasta diciembre de 2019 no se registraron nuevos casos de MenB entre casi 34.500 estudiantes (edad media: 15,6 años) de 237 escuelas australianas vacunados con 4CMenB entre 2017 y 2018 mientras participaban en un amplio estudio de portación (79).
Como el intervalo mínimo entre dos dosis a partir de los 2 años es de un mes (56), 4CMenB ofrece una protección temprana frente a MenB, atributo que podría mejorar el cumplimiento. Esta flexibilidad para completar la pauta de vacunación puede ser un factor importante, especialmente de los adolescentes, a menudo reacios a acudir a la cita (80). De hecho, según un análisis reciente de datos de vacunación de más de 78.000 adolescentes y adultos estadounidenses, había más probabilidades de completar la pauta de vacunación frente a MenB cuanto mayor era su flexibilidad (81). En otro estudio se observó que los adolescentes vacunados con 2 dosis de 4CMenB a los 11-17 años mantenían niveles protectores de anticuerpos hasta 7,5 años después de la primovacunación: 44 %, 84 %, 29 % y 81 % frente a fHbp, NadA, PorA y NHBA, respectivamente (82). Por tanto, los sujetos vacunados de este grupo etario estarían protegidos durante el período de alto riesgo de padecer EMI (82). Además, el recuerdo administrado a los 4 o 7,5 años desde la primovacunación indujo niveles sustanciales de anticuerpos, por lo que, 4CMenB induce una fuerte respuesta anamnésica. Este hallazgo indica que los sujetos previamente vacunados con 4CMenB tendrían una mejor predisposición inmunológica en caso de brote (82).
Basándose en esta evidencia científica, las guías de la CAV-AEP para 2021 recomiendan incluir la vacunación con 4CMenB en el PNI para todos los lactantes a partir de los 2 meses en España (15,16).
MenB-FHbp
MenB-FHbp contiene dos variantes inmunológicas de la proteína fHbp (83). En 2014 se autorizó MenB-FHbp en Estados Unidos para personas de 10-25 años (84) y en 2017 en Europa para el grupo etario de ≥10 años (85) con una pauta de dos o tres dosis (tabla 2).
MenB-FHbp se administró a universitarios en Rhode Island, Estados Unidos, tras un brote de MenB (10,86). Los datos clínicos de los estudios de la fase III mostraron una inmunogenicidad superior al umbral en el 86,4-99,5 % de los participantes de 10-18 años después de la tercera dosis, y un perfil de seguridad aceptable (87). No se dispone de datos de la vida real para esta vacuna.
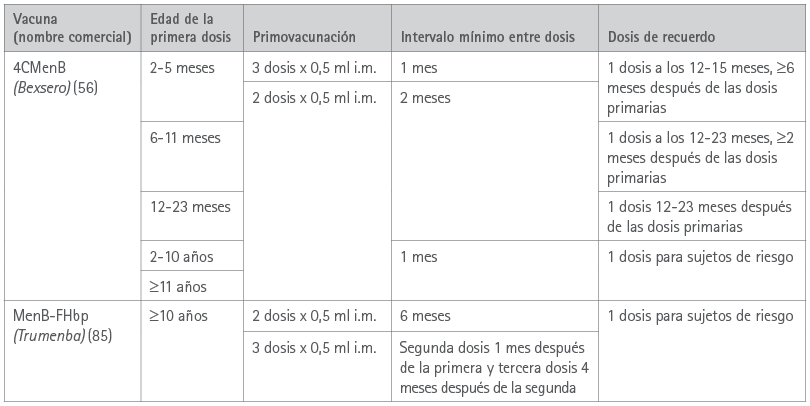
Tabla 2 Indicaciones, pauta y posología de las vacunas frente al serogrupo meningocócico B en España
4CMenB: vacuna de 4 componentes frente al serogrupo meningocócico B; i.m.: intramuscular; MenB-FHbp: vacuna de 2 componentes frente a lo serogrupo meningocócico B.
Fuente: resumen de las características de los productos Bexsero (56) y Trumenba (85).
Rol de los farmacéuticos
La contribución de los farmacéuticos a los servicios de vacunación varía según los países (88,89). En España, la ley asiste a los farmacéuticos para prestar servicios de asesoramiento, dispensación de medicamentos y seguimiento de pacientes (90-92). Además, como los farmacéuticos pueden detectar a las personas de mayor riesgo pueden orientarlas sobre sus necesidades concretas de vacunación, y aconsejarles que acudan a su centro de salud, para que en caso de que fuera adecuado, su médico le prescriba la vacuna indicada a su perfil clínico (86).
Informar al público de las vacunas forma parte del quehacer diario del farmacéutico (93): las encuestas en farmacias comunitarias revelan que más del 90 % de los pacientes preguntan sobre vacunas (94). En efecto, los farmacéuticos son canales esenciales de información válida y cuentan con la confianza mayoritaria del público (88,93). Estos profesionales sanitarios, al ser más accesibles al público (91), a menudo se convierten en educadores de la población sobre los beneficios de las vacunas y ayudan a reforzar la concienciación sobre la importancia de completar las pautas vacunales (88,89). El rol educativo de los farmacéuticos está respaldado con programas formativos, que no solo incluyen información básica sobre manipulación y conservación de vacunas, sino también conocimientos técnicos de vacunas como indicaciones, contraindicaciones, datos de seguridad o detección de posibles efectos secundarios (91).
En el caso de la vacunación meningocócica, esperamos que la información ofrecida en esta revisión sirva de referencia a los farmacéuticos en sus respuestas a padres y pacientes sobre las ventajas, el calendario o las dosis de recuerdo de las vacunas. Estas medidas ayudarán además a los farmacéuticos a cumplir su misión, especialmente en épocas complicadas de pandemia (17).
Conclusiones
La EMI es una infección bacteriana poco frecuente pero devastadora que puede cursar con meningitis y sepsis. Puede ocasionar la muerte o amputación de miembros, convulsiones, ictus, problemas de audición u otras secuelas graves. Sin embargo, es una enfermedad prevenible mediante vacunación. La OMS se ha fijado como objetivo derrotar a la meningitis para 2030.
Si bien hace años que se dispone de vacunas frente a cuatro serogrupos responsables de la EMI (A, C, W e Y), no se había desarrollado ninguna frente a MenB, el serogrupo causante de la mayoría de las infecciones en Europa, América y Australia. La investigación en vacunas frente a este serogrupo supuso un desafío para los investigadores. El desarrollo de 4CMenB y MenB-FHbp se logró hace bien poco. Ambas se han utilizado en brotes. El CAV-AEP recomienda la administración sistemática de 4CMenB a lactantes. Los datos favorables de efectividad, impacto y seguridad obtenidos tras administrar millones de dosis de 4CMenB demuestran que la vacuna es efectiva y bien tolerada y previene frente al serogrupo que más EMI produce en España.
Así pues, al margen de que la vacunación frente a la EMI se incluya en el PNI sistemático, la actuación de los farmacéuticos comunitarios es clave para asesorar debidamente a los padres para que estos puedan tomar una decisión informada y respaldando así las recomendaciones de los pediatras.
Agradecimientos
Los autores expresan su agradecimiento a Amir Diab Cáceres y Natalia González Quero (GSK, España) por el apoyo científico durante el desarrollo de este manuscrito. Los autores también desean agradecer la asistencia editorial y la coordinación del manuscrito por parte de la plataforma Business & Decision Life Sciences, en nombre de GSK. Grégory Leroux coordinó el desarrollo del manuscrito y la asistencia editorial y Athanasia Benekou proporcionó ayuda para la redacción.
Referencias bibliográficas
- Caugant DA, Brynildsrud OB. Neisseria meningitidis: using genomics to understand diversity, evolution and pathogenesis. Nat Rev Microbiol. 2020;18(2):84-96. doi:10.1038/s41579-019-0282-6
- Pace D, Pollard AJ. Meningococcal disease: clinical presentation and sequelae. Vaccine. 2012;30 Suppl 2:B3-9. doi:10.1016/j.vaccine.2011.12.062
- World Health Organization. Meningitis. Overview. 2020. Disponible en: https://www.who.int/emergencies/diseases/meningitis/en/. Meningococcal meningitis. Key facts. 2018. Disponible en: https://www.who.int/en/news-room/fact-sheets/detail/meningococcal-meningitis. Defeating bacterial meningitis by 2030. 2018. Disponible en: https://www.who.int/emergencies/diseases/meningitis/meningitis-2030.pdf?ua=1&ua=1. Baseline situation analysis. 2019. Disponible en: https://www.who.int/immunization/research/BSA_20feb2019.pdf?ua=1. A roadmap. Draft goals and milestones. 2019. Disponible en: https://www.who.int/immunization/sage/meetings/2019/april/1_DEFEATING_MENINGITIS_BY_2030_A_ROADMAP_Draft_goals_and_milestones.pdf?ua=1. Wilton Park. Meningitis Research Foundation. A global vision for meningitis by 2030 and an action plan to get there. 2017. Disponible en: https://www.wiltonpark.org.uk/wp-content/uploads/WP1521-Report.pdf. [Consultado 3/9/2020].
- Cabellos C, Pelegrín I, Benavent E, Gudiol F, Tubau F, Garcia-Somoza D, et al. Invasive Meningococcal Disease: What We Should Know, Before It Comes Back. Open Forum Infect Dis. 2019;6(3):ofz059. doi:10.1093/ofid/ofz059
- Dwilow R, Fanella S. Invasive meningococcal disease in the 21st century-an update for the clinician. Curr Neurol Neurosci Rep. 2015;15(3):2. doi:10.1007/s11910-015-0524-6
- Deceuninck G, Lefebvre B, Tsang R, Betala-Belinga JF, De Serres G, De Wals P. Impact of a mass vaccination campaign against Serogroup B meningococcal disease in the Saguenay-Lac-Saint-Jean region of Quebec four years after its launch. Vaccine. 2019;37(31):4243-4245. doi:10.1016/j.vaccine.2019.06.021
- Soeters HM, McNamara LA, Whaley M, Wang X, Alexander-Scott N, Kanadanian KV, et al. Serogroup B Meningococcal Disease Outbreak and Carriage Evaluation at a College - Rhode Island, 2015. MMWR Morb Mortal Wkly Rep. 2015;64(22):606-7.
- Abad R, Martinón-Torres F, Santolaya ME, Banzhoff A, González-Inchausti C, Graña MG, et al. [From a pathogen’s genome to an effective vaccine: the four-component meningococcal serogroup B vaccine]. Rev Esp Quimioter. 2019;32(3):208-16.
- European Centre for Disease Prevention and Control. Expert opinion on the introduction of the meningococcal B (4CMenB) vaccine in the EU/EEA. 2017. Disponible en: https://www.ecdc.europa.eu/sites/default/files/documents/Introduction-of-4CMenB-vaccine.pdf [Consultado 3/9/2020].
- Wilkins AL, Snape MD. Emerging clinical experience with vaccines against group B meningococcal disease. Vaccine. 2018;36(36):5470-5476. doi:10.1016/j.vaccine.2017.07.056
- Boletín Oficial de Castilla y León. Consejería de Sanidad. Núm. 78 Jueves, 25 de abril de 2019 Pág. 20762. Disponible en: http://bocyl.jcyl.es/boletines/2019/04/25/pdf/BOCYL-D-25042019-41.pdf. [Consultado 3/9/2020].
- Boletín Oficial de Canarias. Consejería de Sanidad. 3325 ORDEN de 28 de junio de 2019, por la que se aprueba el Calendario Vacunal para todas las edades de la vida en la Comunidad Autónoma de Canarias. BOC Nº 126. Miércoles 3 de julio de 2019 - 3325. Disponible en: http://www.gobiernodecanarias.org/boc/2019/126/001.html [Consultado 3/9/2020].
- Grupo de trabajo vacunación frente a EMI de la Ponencia de Programa y Registro de Vacunaciones. Recomendaciones de vacunación frente a enfermedad meningocócica invasiva. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Consumo y Bienestar Social, Marzo 2019. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/docs/Recomendaciones_Vacunacion_Meningococo.pdf. [Consultado 3/9/2020].
- Junta de Andalucia Consejería de Salud y Familias. Calendario de vacunaciones recomendado para todas las edades - infancia, adolescencia, y edad adulta - Andalucía 2020. Instrucción DGSPyOF-8/2019. Disponible en: https://www.juntadeandalucia.es/export/drupaljda/csafaCalendarioVacunacion2020.pdf. [Consultado 13/10/2020].
- Asociación Española de Pediatría. Comité Asesor de Vacunas. Calendario de Vacunaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2021. 1 de enero de 2021. Disponible en: https://vacunasaep.org/profesionales/calendario-de-vacunaciones-de-la-aep-2021. [Consultado 15/1/2021].
- Álvarez García FJ, Cilleruelo Ortega MJ, Álvarez Aldeán J, Garcés-Sánchez M, García Sánchez N, Garrote Llanos E, et al. [Immunisation schedule of the Pediatric Spanish Association: 2021 recommendations]. An Pediatr (Barc). 2021;94(1):53.e1-53.e10. doi:10.1016/j.anpedi.2020.10.002
- World Health Organization. Maintaining essential health services: operational guidance for the COVID-19 context interim guidance. 2020. Disponible en: https://www.who.int/publications/i/item/WHO-2019-nCoV-essential-health-services-2020.1. [Consultado 3/ 9/2020].
- GAVI. At least 80 million children at risk of disease as COVID-19 disrupts vaccination efforts, warn Gavi, WHO and UNICEF. 22 May 2020. Disponible en: https://www.gavi.org/news/media-room/least-80-million-children-risk-disease-covid-19-disrupts-vaccination-efforts. [Consultado 3/9/2020].
- European Centre for Disease Prevention and Control. Surveillance Atlas of Infectious Diseases. 2018. Disponible en: https://atlas.ecdc.europa.eu/public/index.aspx?Dataset=27&HealthTopic=36. Factsheet about meningococcal disease. 2019. Disponible en: https://www.ecdc.europa.eu/en/meningococcal-disease/factsheet. [Consultado 3/9/2020].
- Acevedo R, Bai X, Borrow R, Caugant DA, Carlos J, Ceyhan M, et al. The Global Meningococcal Initiative meeting on prevention of meningococcal disease worldwide: Epidemiology, surveillance, hypervirulent strains, antibiotic resistance and high-risk populations. Expert Rev Vaccines. 2019;18(1):15-30. doi:10.1080/14760584.2019.1557520
- Read RC. Neisseria meningitidis; clones, carriage, and disease. Clin Microbiol Infect. 2014;20(5):391-395. doi:10.1111/1469-0691.12647
- Ministerio de Ciencia, Innovación y Universidades. Enfermedad meningocócica, Vigilancia de la temporada 2017-2018. Resultados de la Red Nacional de Vigilancia Epidemiológica. 2019. Disponible en: https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Documents/archivos%20A-Z/Enfer_Meningoc%C3%B3cica/RENAVE_EMI-2017-18.pdf. [Consultado 3/9/2020].
- Wang B, Santoreneos R, Giles L, Haji Ali Afzali H, Marshall H. Case fatality rates of invasive meningococcal disease by serogroup and age: A systematic review and meta-analysis. Vaccine. 2019;37(21):2768-2782. doi:10.1016/j.vaccine.2019.04.020
- Peterson ME, Li Y, Bita A, Moureau A, Nair H, Kyaw MH, et al. Meningococcal serogroups and surveillance: a systematic review and survey. J Glob Health. 2019;9(1):010409. doi:10.7189/jogh.09.010409
- Whittaker R, Dias JG, Ramliden M, Ködmon C, Economopoulou A, Beer N, et al. The epidemiology of invasive meningococcal disease in EU/EEA countries, 2004-2014. Vaccine. 2017;35(16):2034-2041. doi:10.1016/j.vaccine.2017.03.007
- Christensen H, May M, Bowen L, Hickman M, Trotter CL. Meningococcal carriage by age: a systematic review and meta-analysis. Lancet Infect Dis. 2010;10(12):853-861. doi:10.1016/S1473-3099(10)70251-6
- Pelton SI. The Global Evolution of Meningococcal Epidemiology Following the Introduction of Meningococcal Vaccines. J Adolesc Health. 2016;59(2):S3-S11. doi:10.1016/j.jadohealth.2016.04.012
- Balmer P, Burman C, Serra L, York LJ. Impact of meningococcal vaccination on carriage and disease transmission: A review of the literature. Hum Vaccin Immunother. 2018;14(5):1118-1130. doi:10.1080/21645515.2018.1454570
- Stephens DS. Biology and pathogenesis of the evolutionarily successful, obligate human bacterium Neisseria meningitidis. Vaccine. 2009;27(Suppl 2):B71-B77. doi:10.1016/j.vaccine.2009.04.070
- Coureuil M, Lécuyer H, Bourdoulous S, Nassif X. A journey into the brain: insight into how bacterial pathogens cross blood-brain barriers. Nat Rev Microbiol. 2017;15(3)149-159. doi:10.1038/nrmicro.2016.178
- Pathan N, Faust SN, Levin M. Pathophysiology of meningococcal meningitis and septicaemia. Arch Dis Child. 2003;88(7):601-607. doi:10.1136/adc.88.7.601
- van de Beek D, de Gans J, Spanjaard L, Weisfelt M, Reitsma JB, Vermeulen M. Clinical features and prognostic factors in adults with bacterial meningitis. N Engl J Med. 2004;351(18):1849-1859. doi:10.1056/NEJMoa040845
- Moore JE. Meningococcal Disease Section 3: Diagnosis and Management: MeningoNI Forum (see page 87(2) 83 for full list of authors). Ulster Med J. 2018;87(2):94-98.
- Campbell H, Parikh SR, Borrow R, Kaczmarski E, Ramsay ME, Ladhani SN. Presentation with gastrointestinal symptoms and high case fatality associated with group W meningococcal disease (MenW) in teenagers, England, July 2015 to January 2016. Euro Surveill. 2016;21(12). doi:10.2807/1560-7917.ES.2016.21.12.30175
- Chaudhuri A, Martinez-Martin P, Kennedy PG, Andrew Seaton R, Portegies P, Bojar M, et al. EFNS guideline on the management of community-acquired bacterial meningitis: report of an EFNS Task Force on acute bacterial meningitis in older children and adults. Eur J Neurol. 2008;15(7):649-659. doi:10.1111/j.1468-1331.2008.02193.x
- Køster-Rasmussen R, Korshin A, Meyer CN. Antibiotic treatment delay and outcome in acute bacterial meningitis. J Infect. 2008;57(6):449-454. doi:10.1016/j.jinf.2008.09.033
- Proulx N, Fréchette D, Toye B, Chan J, Kravcik S. Delays in the administration of antibiotics are associated with mortality from adult acute bacterial meningitis. QJM. 2005;98(4):291-298. doi:10.1093/qjmed/hci047
- Thompson MJ, Ninis N, Perera R, Mayon-White R, Phillips C, Bailey L, et al. Clinical recognition of meningococcal disease in children and adolescents. Lancet. 2006;367(9508):397-403. doi:10.1016/S0140-6736(06)67932-4
- van de Beek D, Cabellos C, Dzupova O, Esposito S, Klein M, Kloek AT, et al. ESCMID guideline: diagnosis and treatment of acute bacterial meningitis. Clin Microbiol Infect. 2016;22 Suppl 3:S37-62. doi:10.1016/j.cmi.2016.01.007
- McGill F, Heyderman RS, Michael BD, Defres S, Beeching NJ, Borrow R, et al. The UK joint specialist societies guideline on the diagnosis and management of acute meningitis and meningococcal sepsis in immunocompetent adults. J Infect. 2016;72(4):405-438. doi:10.1016/j.jinf.2016.01.007
- Cohn AC, MacNeil JR, Clark TA, Ortega-Sanchez IR, Briere EZ, Meissner HC, et al. Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2013;62(RR-2):1-28.
- McNamara LA, MacNeil JR, Cohn AC, Stephens DS. Mass chemoprophylaxis for control of outbreaks of meningococcal disease. Lancet Infect Dis. 2018;18(9):e272-e81. doi:10.1016/S1473-3099(18)30124-5
- Artenstein AW. Vaccines: A Biography: Springer New York: Springer-Verlag; 2010. 402 p.
- Goldschneider I, Gotschlich EC, Artenstein MS. Human immunity to the meningococcus. II. Development of natural immunity. J Exp Med. 1969;129(6):1327-1348. doi:10.1084/jem.129.6.1327
- Vipond C, Care R, Feavers IM. History of meningococcal vaccines and their serological correlates of protection. Vaccine. 2012;30 Suppl 2:B10-B17. doi:10.1016/j.vaccine.2011.12.060
- Dretler AW, Rouphael NG, Stephens DS. Progress toward the global control of Neisseria meningitidis: 21st century vaccines, current guidelines, and challenges for future vaccine development. Hum Vaccin Immunother. 2018;14(5):1146-1160. doi:10.1080/21645515.2018.1451810
- Maiden MC, Ibarz-Pavón AB, Urwin R, Gray SJ, Andrews NJ, Clarke SC, et al. Impact of meningococcal serogroup C conjugate vaccines on carriage and herd immunity. J Infect Dis. 2008;197(5):737-743. doi:10.1086/527401
- Bai X, Findlow J, Borrow R. Recombinant protein meningococcal serogroup B vaccine combined with outer membrane vesicles. Expert Opin Biol Ther. 2011;11(7):969-985. doi:10.1517/14712598.2011.585965
- Finne J, Leinonen M, Mäkelä PH. Antigenic similarities between brain components and bacteria causing meningitis. Implications for vaccine development and pathogenesis. Lancet. 1983;2(8346):355-357. doi:10.1016/s0140-6736(83)90340-9
- Crum-Cianflone N, Sullivan E. Meningococcal Vaccinations. Infect Dis Ther. 2016;5(2):89-112. doi:10.1007/s40121-016-0107-0
- Beninati C, Arseni S, Mancuso G, Magliani W, Conti S, Midiri A, et al. Protective immunization against group B meningococci using anti-idiotypic mimics of the capsular polysaccharide. J Immunol. 2004;172(4):2461-2468. doi:10.4049/jimmunol.172.4.2461
- Feavers IM, Maiden MCJ. Recent Progress in the Prevention of Serogroup B Meningococcal Disease. Clin Vaccine Immunol. 2017;24(5):e00566-16. doi:10.1128/CVI.00566-16
- Holst J, Oster P, Arnold R, Tatley MV, Naess LM, Aaberge IS, et al. Vaccines against meningococcal serogroup B disease containing outer membrane vesicles (OMV): lessons from past programs and implications for the future. Hum Vaccin Immunother. 2013;9(6):1241-1253. doi:10.4161/hv.24129
- Rivero-Calle I, Raguindin PF, Gómez-Rial J, Rodriguez-Tenreiro C, Martinón-Torres F. Meningococcal Group B Vaccine For The Prevention Of Invasive Meningococcal Disease Caused By Neisseria meningitidis Serogroup B. Infect Drug Resist. 2019;12:3169-3188. doi:10.2147/IDR.S159952
- Del Tordello E, Serruto D. Functional genomics studies of the human pathogen Neisseria meningitidis. Brief Funct Genomics. 2013;12(4):328-340. doi:10.1093/bfgp/elt018
- European Medicines Agency. Bexsero - Meningococcal group B Vaccine. EPAR - Product Information. 2012. Disponible en: https://www.ema.europa.eu/en/documents/product-information/bexsero-epar-product-information_en.pdf. [Consultado 3/9/2020].
- Watson PS, Novy PL, Friedland LR. Potential benefits of using a multicomponent vaccine for prevention of serogroup B meningococcal disease. Int J Infect Dis. 2019;85:22-27. doi:10.1016/j.ijid.2019.05.019
- Rappuoli R, Pizza M, Masignani V, Vadivelu K. Meningococcal B vaccine (4CMenB): the journey from research to real world experience. Expert Rev Vaccines. 2018;17(12):1111-1121. doi:10.1080/14760584.2018.1547637
- Vogel U, Taha MK, Vazquez JA, Findlow J, Claus H, Stefanelli P, et al. Predicted strain coverage of a meningococcal multicomponent vaccine (4CMenB) in Europe: a qualitative and quantitative assessment. Lancet Infect Dis. 2013;13(5):416-425. doi:10.11016/S1473-3099(13)70006-9
- Ladhani SN, Giuliani MM, Biolchi A, Pizza M, Beebeejaun K, Lucidarme J, et al. Effectiveness of Meningococcal B Vaccine against Endemic Hypervirulent Neisseria meningitidis W Strain, England. Emerg Infect Dis. 2016;22(2):309-311. doi:10.3201/eid2202.150369
- Hong E, Giuliani MM, Deghmane AE, Comanducci M, Brunelli B, Dull P, et al. Could the multicomponent meningococcal serogroup B vaccine (4CMenB) control Neisseria meningitidis capsular group X outbreaks in Africa? Vaccine. 2013;31(7):1113-1116. doi:10.1016/j.vaccine.2012.12.022
- Isitt C, Cosgrove CA, Ramsay ME, Ladhani SN. Success of 4CMenB in preventing meningococcal disease: evidence from real-world experience. Arch Dis Child. 2020;105(8):784-790. doi:10.1136/archdischild-2019-318047
- Ladhani SN, Campbell H, Andrews N, Parikh SR, White J, Edelstein M, et al. First real world evidence of meningococcal group B vaccine, 4CMenB, protection against meningococcal group W disease; prospective enhanced national surveillance, England. Clin Infect Dis. 2020. [Epub antes de imprimir]. doi:10.1093/cid/ciaa1244
- Watson PS, Turner DP. Clinical experience with the meningococcal B vaccine, Bexsero(®): Prospects for reducing the burden of meningococcal serogroup B disease. Vaccine. 2016;34(5):875-880. doi:10.1016/j.vaccine.2015.11.057
- Public Health England. MenB vaccination: introduction from September 2015. 2015. Disponible en: https://www.gov.uk/government/publications/menb-vaccination-introduction-from-1-september-2015. [Consultado 3/9/2020].
- Parikh SR, Andrews NJ, Beebeejaun K, Campbell H, Ribeiro S, Ward C, et al. Effectiveness and impact of a reduced infant schedule of 4CMenB vaccine against group B meningococcal disease in England: a national observational cohort study. Lancet. 2016;388(10061):2775-2782. doi:10.1016/S0140-6736(16)31921-3
- Ladhani SN, Ramsay M, Borrow R, Riordan A, Watson JM, Pollard AJ. Enter B and W: two new meningococcal vaccine programmes launched. Arch Dis Child. 2016;101(1):91-95. doi:10.1136/archdischild-2015-308928
- Ladhani SN, Andrews N, Parikh SR, Campbell H, White J, Edelstein M, et al. Vaccination of Infants with Meningococcal Group B Vaccine (4CMenB) in England. N Engl J Med. 2020;382:309-317. doi:10.1056/NEJMoa1901229
- Zákon cˇ. 48/1997 Sb. Zákon o verˇejném zdravotním pojišteˇní a o zmeˇneˇ a doplneˇní neˇkterých souvisejících zákonu˚ [Act on Public Health Insurance and on Amendments to Certain Related Acts]. 1997. Disponible en: https://www.zakonyprolidi.cz/cs/1997-48. [Consultado 3/9/2020].
- SAÚDE. Gabinete do Secretário de Estado da Saúde. Despacho n.º 12434/2019. Diário da República, 2.ª série. N.º 250. 30 de dezembro de 2019. Pág. 30. 2019. Disponible en: https://dre.pt/application/conteudo/127608823. [Consultado 8/10/2020].
- Government of Malta. Primary Child & Youth Health & Immunisation. Vaccines. 2020. Disponible en: https://deputyprimeminister.gov.mt/en/phc/pchyhi/Pages/Vaccines.aspx. [Consultado 8/10/2020].
- Government of South Australia. Meningococcal B Immunisation Program. 2020. Disponible en: https://www.sahealth.sa.gov.au/wps/wcm/connect/public+content/sa+health+internet/conditions/immunisation/immunisation+programs/meningococcal+b+immunisation+program. [Consultado 8/10/2020].
- Parikh SR, Campbell H, Bettinger JA, Harrison LH, Marshall HS, Martinon-Torres F, et al. The everchanging epidemiology of meningococcal disease worldwide and the potential for prevention through vaccination. J Infect. 2020;81(4):483-498. doi:10.1016/j.jinf.2020.05.079
- Pizza M, Bekkat-Berkani R, Rappuoli R. Vaccines against Meningococcal Diseases. Microorganisms. 2020;8(10):1521. doi:10.3390/microorganisms8101521
- Azzari C, Moriondo M, Nieddu F, Guarnieri V, Lodi L, Canessa C, et al. Effectiveness and Impact of the 4CMenB Vaccine against Group B Meningococcal Disease in Two Italian Regions Using Different Vaccination Schedules: A Five-Year Retrospective Observational Study (2014-2018). Vaccines (Basel). 2020;8(3):E469. doi:10.3390/vaccines8030469
- Rodrigues FMP, Marlow R, Simões MJ, Danon L, Ladhani S, Finn A. Association of Use of a Meningococcus Group B Vaccine With Group B Invasive Meningococcal Disease Among Children in Portugal. JAMA. 2020;324(21):2187-2194. doi:10.1001/jama.2020.20449
- De Serres G, Billard MN, Gariépy MC, Rouleau I, Toth E, Landry M, et al. Short-term safety of 4CMenB vaccine during a mass meningococcal B vaccination campaign in Quebec, Canada. Vaccine. 2018;36(52):8039-8046. doi:10.1016/j.vaccine.2018.10.095
- Public Health England. The impact of the MenB vaccine. 2020. Disponible en: https://publichealthengland.exposure.co/the-impact-of-the-menb-vaccine. [Consultado 3/9/2020].
- Marshall HS, McMillan M, Koehler AP, Lawrence A, Sullivan TR, MacLennan JM, et al. Meningococcal B Vaccine and Meningococcal Carriage in Adolescents in Australia. N Engl J Med. 2020;382:318-327. doi:10.1056/NEJMoa1900236
- Niccolai LM, Hansen CE. Suboptimal uptake of meningococcal vaccines among older adolescents: Barriers, solutions, and future research directions. Hum Vaccin Immunother. 2020;16(12):3208-3212. doi:10.1080/21645515.2020.1754052
- Packnett E, Irwin DE, Novy P, Watson PS, Whelan J, Moore-Schiltz L, et al. Meningococcal-group B (MenB) vaccine series completion and adherence to dosing schedule in the United States: A retrospective analysis by vaccine and payer type. Vaccine. 2019;37(39):5899-5908. doi:10.1016/j.vaccine.2019.06.065
- Watson PS, Novy P, Bekkat-Berkani R, Strubbe F, Banzhoff A. Optimizing the timing of 4CMenB vaccination in adolescents and young adults based on immune persistence and booster response data. Expert Rev Vaccines. 2019;18(4):343-352. doi:10.1080/14760584.2019.1580579
- Gandhi A, Balmer P, York LJ. Characteristics of a new meningococcal serogroup B vaccine, bivalent rLP2086 (MenB-FHbp; Trumenba®). Postgrad Med. 2016;128(6):548-556. doi:10.1080/00325481.2016.1203238
- U.S. Food and Drug Administration. Trumenba (Meningococcal Group B Vaccine). Suspension for intramuscular injection. Highlights of prescribing information. 2018. Disponible en: https://www.fda.gov/files/vaccines,%20blood%20&%20biologics/published/Package-Insert---TRUMENBA.pdf. [Consultado 3/9/2020].
- European Medicines Agency. Trumemba - Meningococcal group B Vaccine. EPAR - Product Information. 2017. Disponible en: https://www.ema.europa.eu/en/documents/product-information/trumenba-epar-product-information_en.pdf. [Consultado 3/9/2020].
- Soeters HM, Whaley M, Alexander-Scott N, Kanadanian KV, MacNeil JR, Martin SW, et al. Meningococcal Carriage Evaluation in Response to a Serogroup B Meningococcal Disease Outbreak and Mass Vaccination Campaign at a College-Rhode Island, 2015-2016. Clin Infect Dis. 2017;64(8):1115-1122. doi:10.1093/cid/cix091
- Burman C, Alderfer J, Snow VT. A review of the immunogenicity, safety and current recommendations for the meningococcal serogroup B vaccine, MenB-FHbp. J Clin Pharm Ther. 2020;45(2):270-281. doi:10.1111/jcpt.13083
- International Pharmaceutical Federation. An overview of current pharmacy impact on immunisation. A global report. 2016. Disponible en: https://www.fip.org/www/streamfile.php?filename=fip/publications/FIP_report_on_Immunisation.pdf. [Consultado 21/10/2020].
- Poudel A, Lau ETL, Deldot M, Campbell C, Waite NM, Nissen LM. Pharmacist role in vaccination: Evidence and challenges. Vaccine. 2019;37(40):5939-5945. doi:10.1016/j.vaccine.2019.08.060
- Gastelurrutia MA, Faus MJ, Martínez-Martínez F. Primary health care policy and vision for community pharmacy and pharmacists in Spain. Pharm Pract (Granada). 2020;18(2):1999. doi:10.18549/PharmPract.2020.2.1999
- General Pharmaceutical Council of Spain. Good Pharmacy Practice in Spanish Community Pharmacy. Madrid, July 2013. Disponible en: https://www.portalfarma.com/Profesionales/Buenas-practicas-profesionales/Documents/Buenas-Practicas-Ingles.pdf. [Consultado 21/10/2020].
- Foro de Atención Farmacéutica-Farmacia Comunitaria (Foro AF-FC). Guía práctica para los Servicios Profesionales Farmacéuticos Asistenciales en la Farmacia Comunitaria. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2019. Disponible en: https://www.portalfarma.com/inicio/serviciosprofesionales/forofarmaciacomunitaria/Documents/2021-guia-practica-spfa.pdf. [Consultado 6/4/2021].
- Isenor JE, Bowles SK. Opportunities for pharmacists to recommend and administer routine vaccines. Can Pharm J (Ott). 2019;152(6):401-405. doi:10.1177/1715163519878473
- Scarpitta F, Restivo V, Bono CM, Sannasardo CE, Vella C, Ventura G, et al. The role of the Community Pharmacist in promoting vaccinations among general population according to the National Vaccination Plan 2017-2019: results from a survey in Sicily, Italy. Ann Ig. 2019;31(2 Suppl 1):25-35. http://dx.doi.org/10.7416/ai.2019.2274
- Comanducci M, Bambini S, Brunelli B, Adu-Bobie J, Aricò B, Capecchi B, et al. NadA, a novel vaccine candidate of Neisseria meningitidis. J Exp Med. 2002;195(11):1445-1454. doi:10.1084/jem.20020407
- Vacca I, Del Tordello E, Gasperini G, Pezzicoli A, Di Fede M, Rossi Paccani S, et al. Neisserial Heparin Binding Antigen (NHBA) Contributes to the Adhesion of Neisseria meningitidis to Human Epithelial Cells. PLoS One. 2016;11(10):e0162878. doi:10.1371/journal.pone.0162878
- Pizza M, Scarlato V, Masignani V, Giuliani MM, Aricò B, Comanducci M, et al. Identification of vaccine candidates against serogroup B meningococcus by whole-genome sequencing. Science. 2000;287(5459):1816-1820. doi:10.1126/science.287.5459.1816
Editado por: © SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria.
© Copyright SEFAC. Sociedad Española de Farmacia Clínica, Familiar y Comunitaria. Este artículo está disponible en la url https://www.farmaceuticoscomunitarios.org/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES


